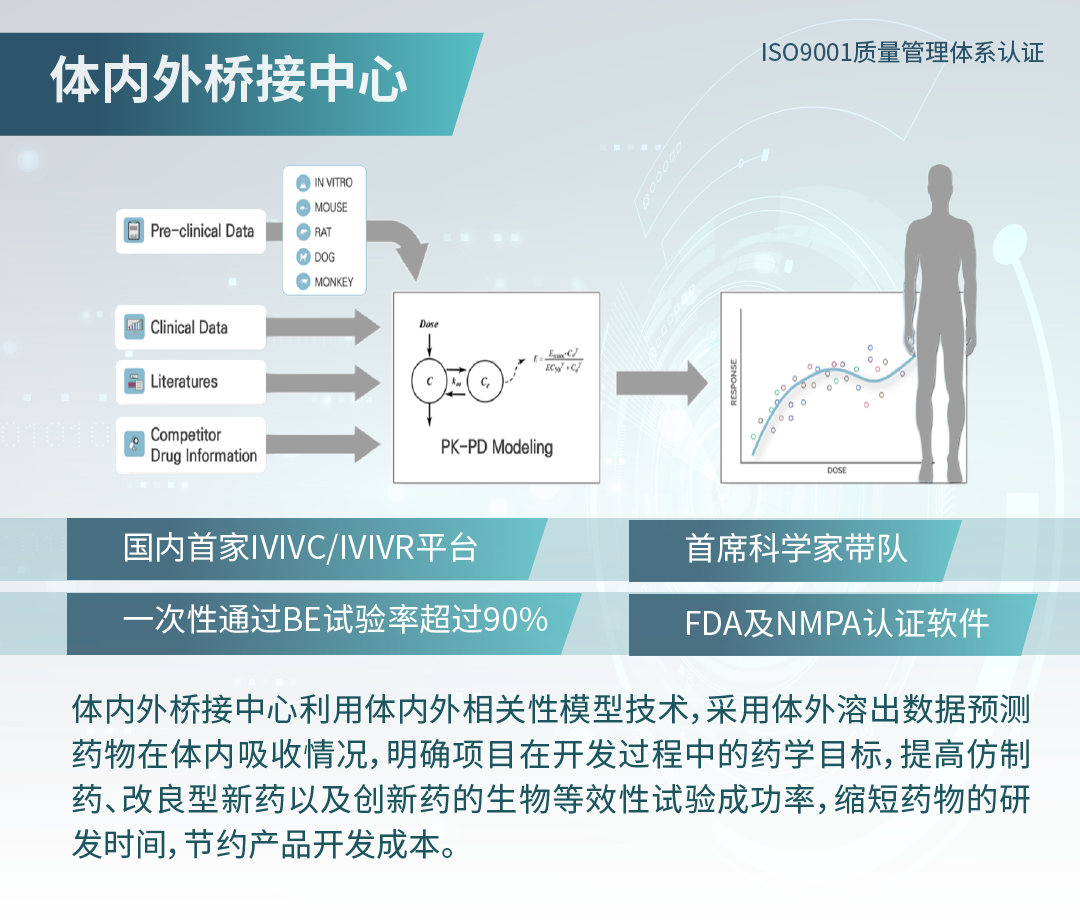
探究个体内变异对于生物等效性(BE)的影响
自一致性评价工作开展以来,生物等效性(BE)试验在仿制药开发过程中具有非常重要的地位。自研品和参比制剂能否实现生物等效,除制剂本身的质量差异外,BE 试验的设计也尤为重要。
BE 试验在设计过程中,需要考虑的因素有受试者人群、样本量、采血点、清洗期、餐食等,其中样本量的设定不仅关系到整个试验的成败,同时涉及到费用和成本问题,具体选取样本量的合适值取决于药物的个体内变异情况。
根据 CDE 颁布的指导原则,生物等效性(BE)的定义为:在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。
大部分 BE 试验采用交叉设计,意味着每个受试者都会服用自研品和参比制剂,同一受试者在不同时期服用制剂产生的差异,被称为个体内变异。
以PASS软件计算样本量为例,介绍个体内变异对于样本量设计的影响。
试验设计为:交叉、两制剂、两周期;假设检验的显著性水平(Alpha)设置为 0.05,试验设计的把握度(Power)为 0.8,T/R 比值设定为 0.95,等效界值设定为 80.00%-125.00%,分别以个体内变异为 15% 和 30% 为例,进行计算,结果如下:

个体内变异为30%,计算样本量如下表:

总结:当个体内变异系数为 15% 时,软件计算所得的样本需求量为 15 例,而当体内变异系数为 30% 时,软件计算所得的样本需求量为 52 例,由此可知:如果一个品种个体内变异越高,满足生物等效性标准所需的受试者样本量就越大。
个体内变异的高低,我们通常可以从 FDA、欧盟、澳大利亚审评报告中获得。如审评报告中没有查到相关信息,我们也可以尝试通过其他信息进行分析。
结合我公司开展生物等效性的经验以及对数据的分析,小编认为造成药物个体内变异较高的主要原因有以下几点。
若药物在整个生理 pH 条件下饱和溶解度的检测结果较低,则意味着药物在胃肠道环境中溶解性较差,药物不能充分溶解就会导致其吸收量偏低。
如奥美沙坦酯片,该原料药溶解性具有显著的 pH 依赖性,在酸性和碱性环境中溶解性较好,但在 pH2.0-pH4.0 介质中几乎不溶。受试者服用药物后,若此时胃中 pH<2.0 药物尚且能够逐渐溶解,但若胃中 pH>2.0 时,药物的溶解性就会显著降低。另外,即使在胃中已溶解的部分药物,当从胃中转运至小肠的过程中,因 pH 值的变化,药物会存在溶解—析出—再溶解的过程。
上述药物的性质导致了奥美沙坦酯片 Cmax、AUC 的个体内变异均较高( 20%-25% 左右)。
阿戈美拉汀片,审评报告中提及空腹状态下个体内变异为 100% 左右。服用高脂餐后,个体内变异还会继续提高。
阿戈美拉汀原料药溶解性和渗透性均较好,审评报告中将其分类为 BCSⅠ类。但该品种的绝对生物利用度仅有不到 5%,这是由于它具有广泛的首过效应,大量药物在进入体循环前就已被代谢。受试者服用药物后,因每个时间段体内环境不同,导致首过效应的程度不同,使得药物生物利用度受到影响,从而造成该品种个体内变异较高。
类似品种还有阿托伐他汀钙和阿奇霉素片,两种原料药溶解性较好,制剂在生理 pH1.2-6.8 介质中均能完全溶出,但两种制剂绝对生物利用度分别为 12%-14% 和 34% ,具有广泛的首过效应,导致两个品种在体内个体内变异较高。
拉西地平片,原料药溶解性很差,为提高溶解性,制剂在制备过程中将原料药从结晶态转化为无定型态,但即使这样原料药的溶解性依旧很差,且该药物在肝脏中存在明显的首过效应,绝对生物利用度仅为 10% 左右。上述两种原因,导致拉西地平片个体内变异为 40%-60% 左右。
高脂餐能够促进或降低药物溶解性,从而造成个体内变异在空腹和餐后状态下的差异。
如头孢呋辛酯干混悬剂,食物的存在使胃肠道中水分减少,药物溶解性降低,导致服用高脂餐后药物吸收量不同程度地降低,出现 Cmax 值变低、个体内变异变高的情况。
而依西美坦片与之相反,餐后的个体内变异较空腹状态下偏低。依西美坦原料药为偏脂溶性,服用高脂餐后,胆汁分泌增多,胆酸离子具有表面活性剂作用,能够增强脂溶性药物的溶解,导致药物在高脂餐条件下溶解性增加,溶解速度及程度的普遍提高会使得个体内变异相应降低。
如药物在酸性介质中容易降解,或在胃中溶解/吸收后易产生副作用,则需要设计成仅在肠道中释放的药物,即肠溶制剂。
肠溶制剂在体内的溶解和吸收较普通口服制剂更易受到体内环境的影响。受试者在服用药物后,不同时期体内环境不同,必然导致药物在体内的释放和吸收的程度有所差异,加之自研品和参比制剂在本身质量方面的差异,综合导致肠溶制剂个体内变异较高,如奥美拉唑肠溶胶囊、兰索拉唑肠溶片、泮托拉唑钠肠溶片和柳氮磺吡啶肠溶片。
为了提高 BE 试验的成功率,针对个体内变异情况不同的品种,所对应的BE方案设计便会有所不同。
一般采用两制剂、单次给药、交叉试验设计即可,等效评价标准为 Cmax、AUC0-t、AUC0-∞,三个参数的 90% 置信区间为 80.00%-125.00% 。
可设计为部分重复(单制剂重复,即三周期)或完全重复(两制剂均重复,即四周期)试验,以便根据参比制剂个体内变异情况,将此类高变异药物的等效性评价标准作适当比例的调整。
例如:在三周期或四周期试验设计中,若参比制剂两周期间的个体内变异较大(Swr≥0.294),等效评价标准将按照 RSABE 法使用试验所得的参比制剂个体内标准差 Swr 值重新计算,所得范围将在 80.00%~125.00% 的基础上适当放宽。
一个品种的个体内变异情况,若无法从文献中获取,可以使用上文提及的方法进行判断。上述判断个体内变异的方式仅为小编从我公司项目经验和数据分析中获得,如大家有不同的想法或意见,欢迎随时和我们交流。
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
