政策法规||国家药监局发布仿制药参比制剂目录(第五十八批)(附本周法规概览09.12-09.16)
01
国家药监局关于发布仿制药参比制剂目录(第五十八批)的通告(2022年第41号)
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物。参比制剂应为处方工艺合理、质量稳定、疗效确切的药品。参比制剂的选择是一致性评价中的重要工作,无论是对仿制药的开发还是对仿制药的质量评价,均是基于对参比制剂的深度解读。

扫描识别图中二维码
查看详细信息

02
关于公开征求《化药口服固体制剂连续制造技术指导原则(征求意见稿)》意见的通知
为鼓励创新和制药现代化,助力 ICH Q13 指导原则在国内的实施,参考相关标准和指南,药品审评中心制定本指导原则,阐明了化药口服固体制剂连续制造的基本考虑,为化药口服固体制剂连续制造技术的研究和评价提供指导。

扫描识别图中二维码
查看详细信息

03
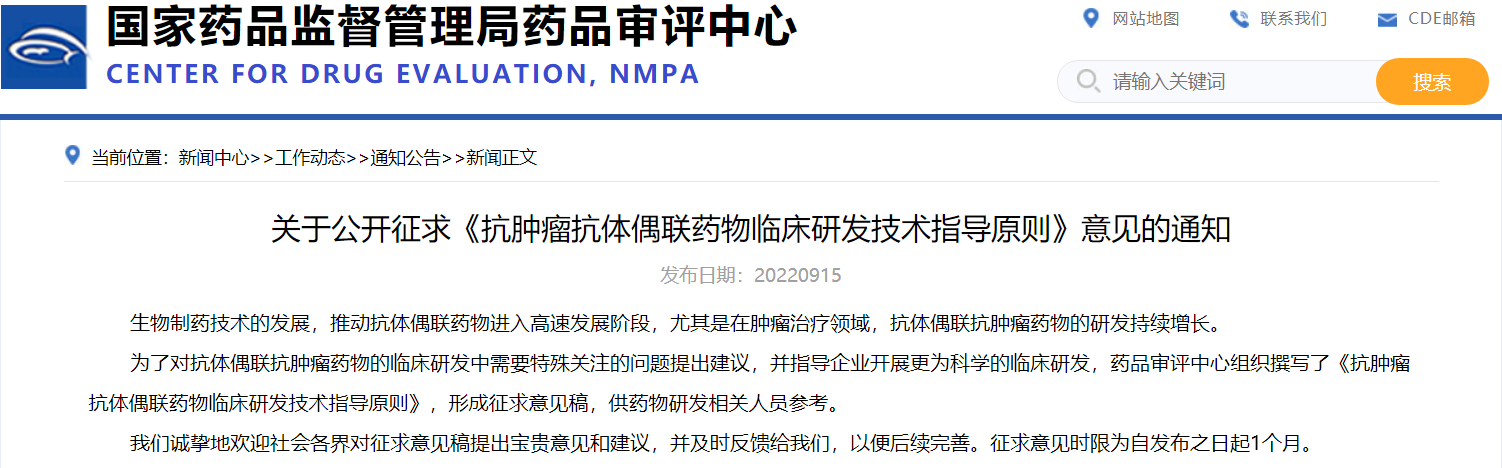
关于公开征求《抗肿瘤抗体偶联药物临床研发技术指导原则》意见的通知
生物制药技术的发展,推动抗体偶联药物进入高速发展阶段,尤其是在肿瘤治疗领域,抗体偶联抗肿瘤药物的研发持续增长。为了对抗体偶联抗肿瘤药物的临床研发中需要特殊关注的问题提出建议,并指导企业开展更为科学的临床研发,药品审评中心组织撰写了《抗肿瘤抗体偶联药物临床研发技术指导原则》,形成征求意见稿,供药物研发相关人员参考。
扫描识别图中二维码
查看详细信息

04
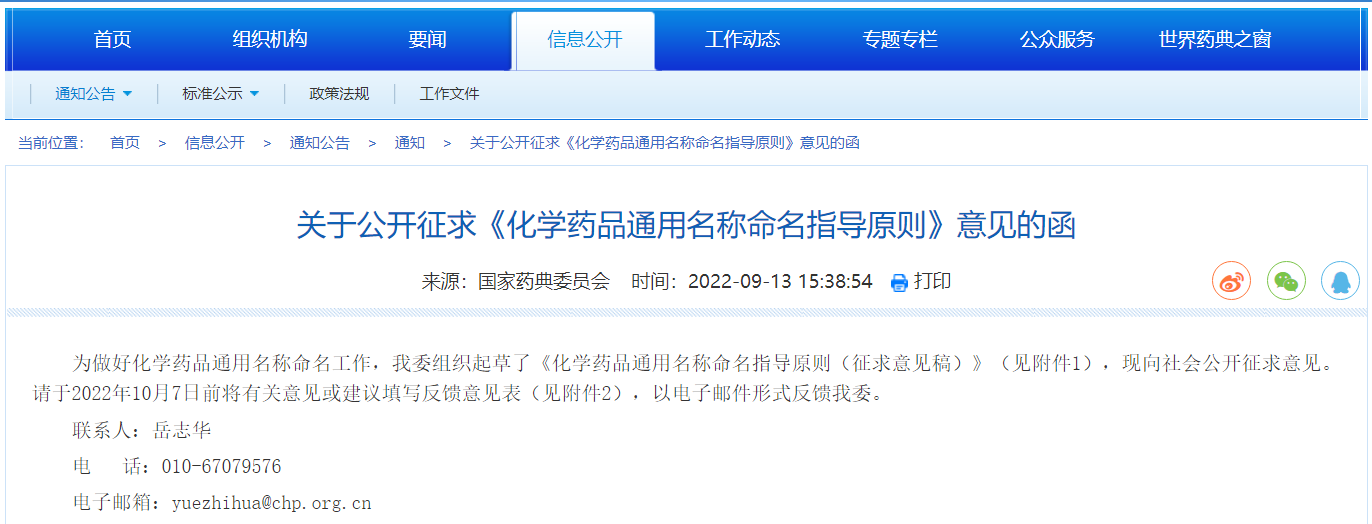
关于公开征求《化学药品通用名称命名指导原则》意见的函
为规范化学药品通用名称(以下简称药品名称) 命名,进一步提高化学药品命名的科学性, 制订本原则。原则中的化学药品包括化学原料药与制剂,制剂中间体参考本原则命名。
扫描识别图中二维码
查看详细信息

关于药审中心与中国药品监督管理研究会合作举办“创新药物临床研发在不同适应症领域的审评考虑”线上培训的通知

扫描识别图中二维码
查看详细信息

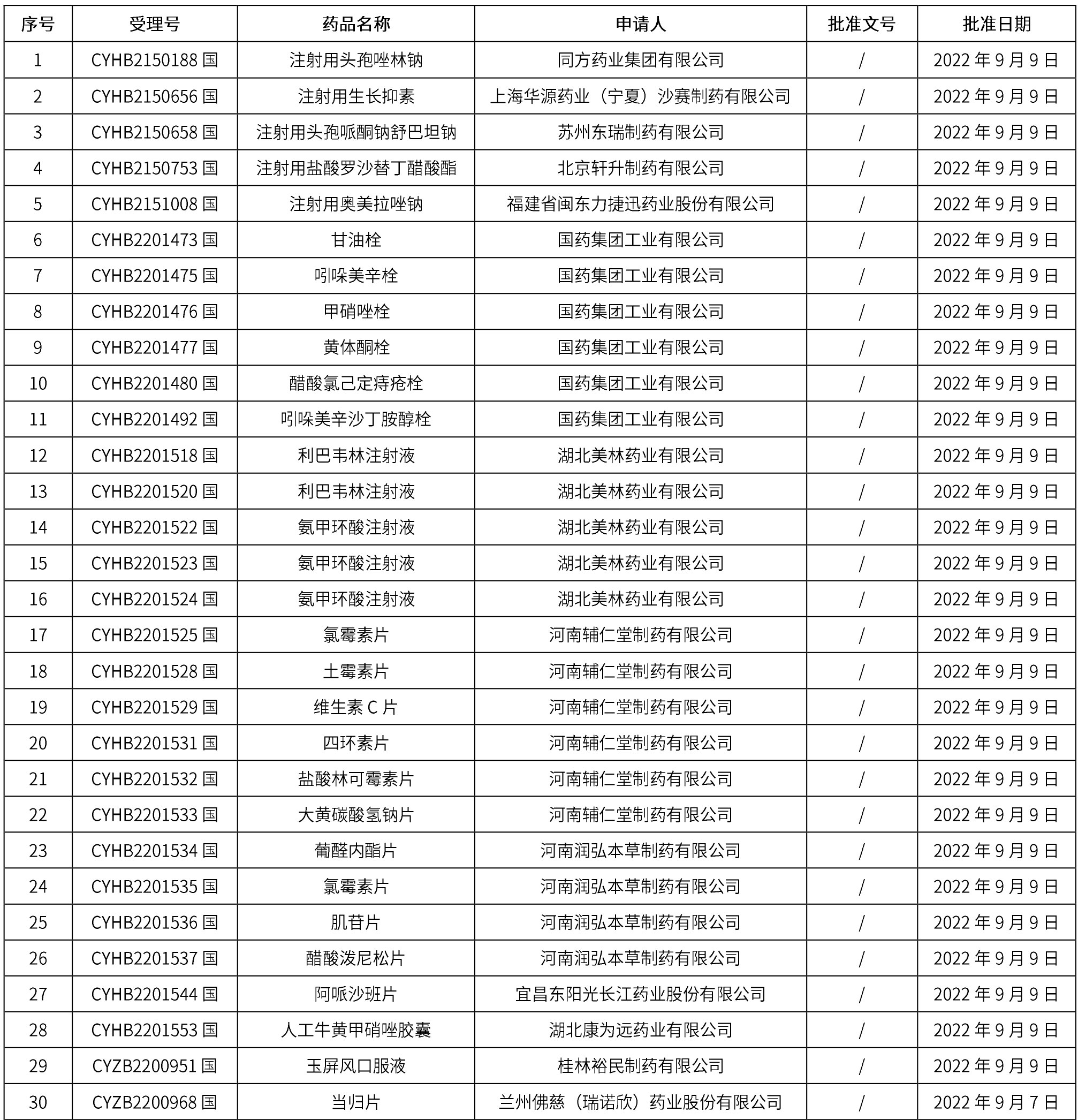
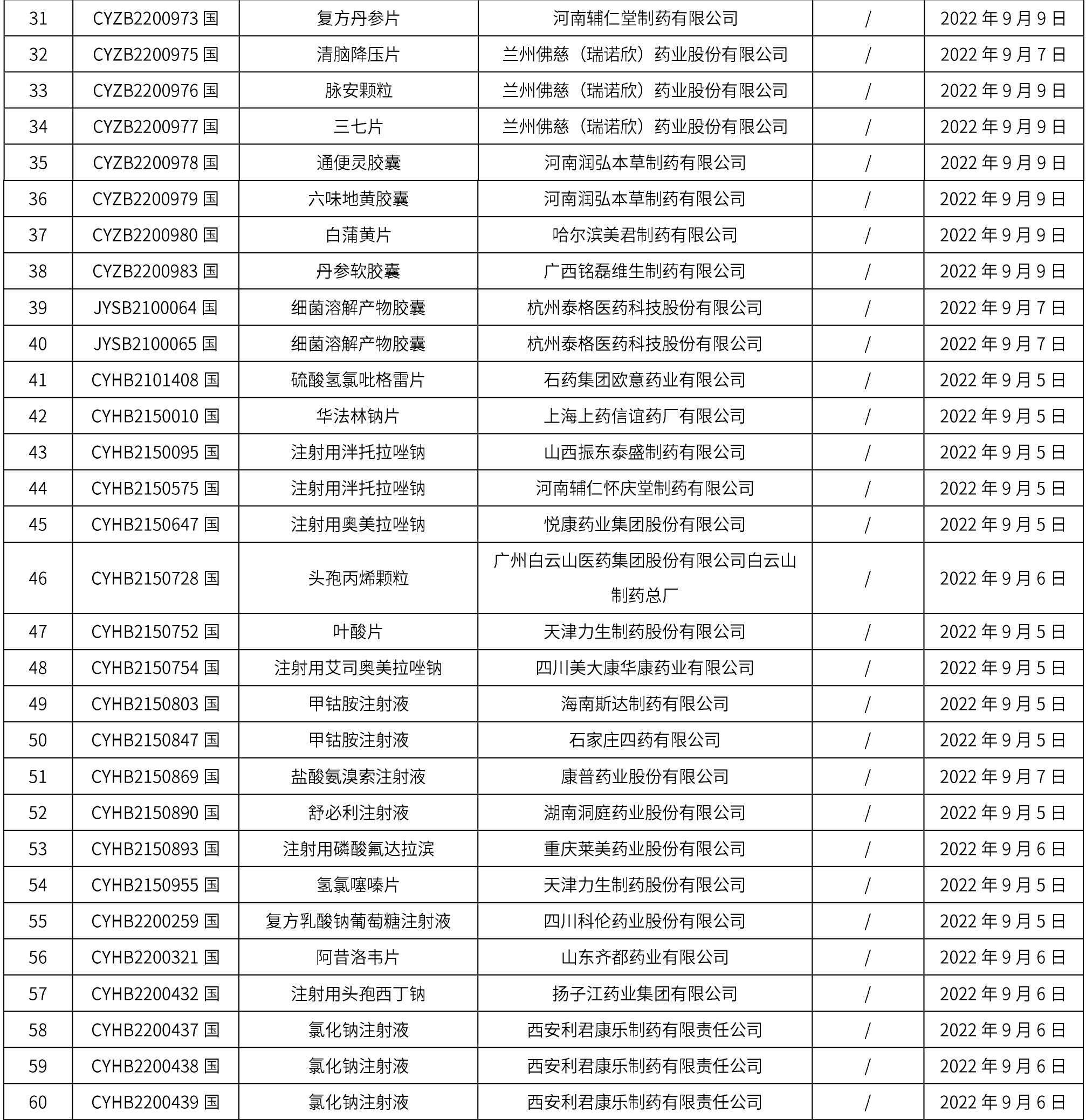
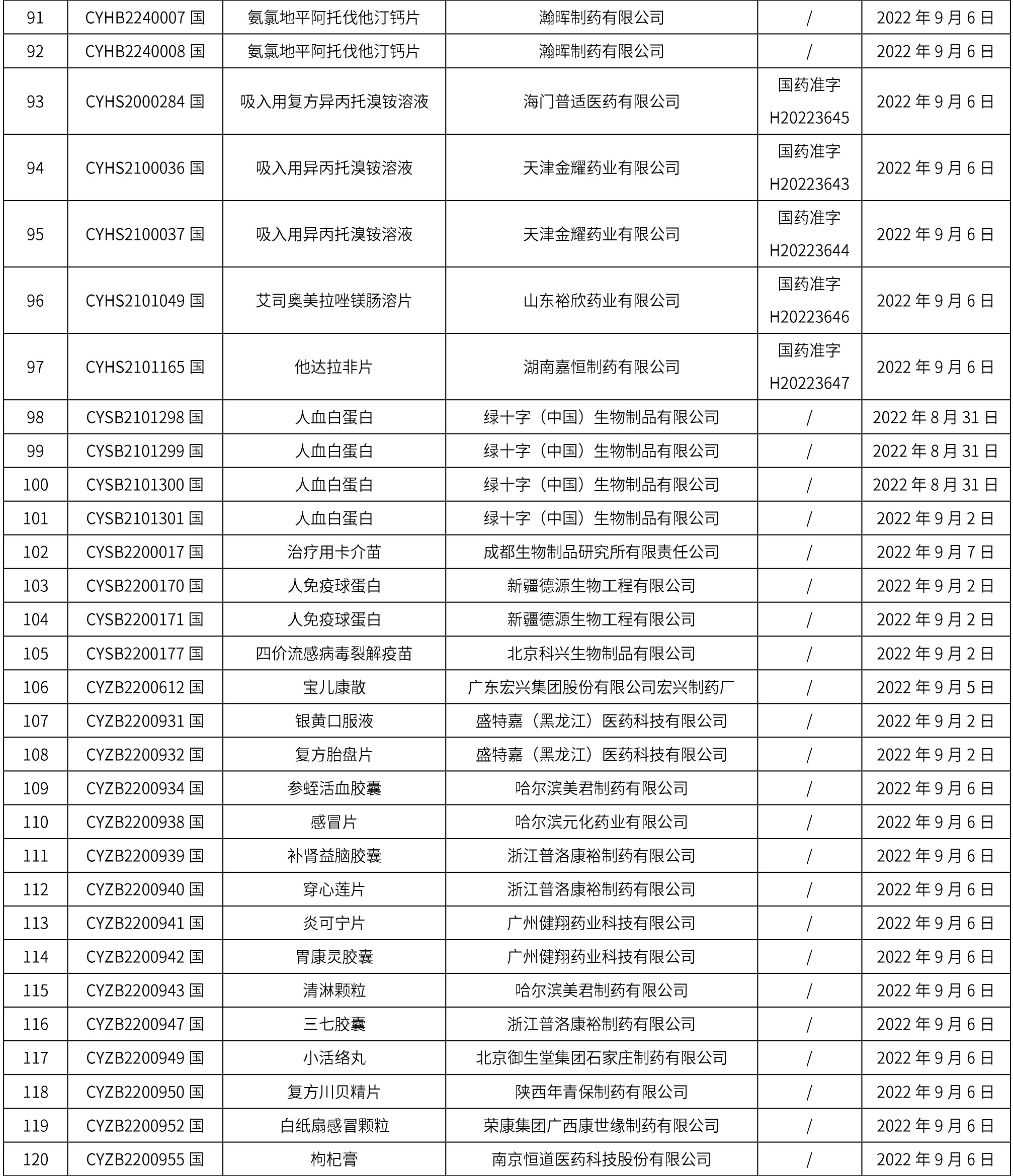
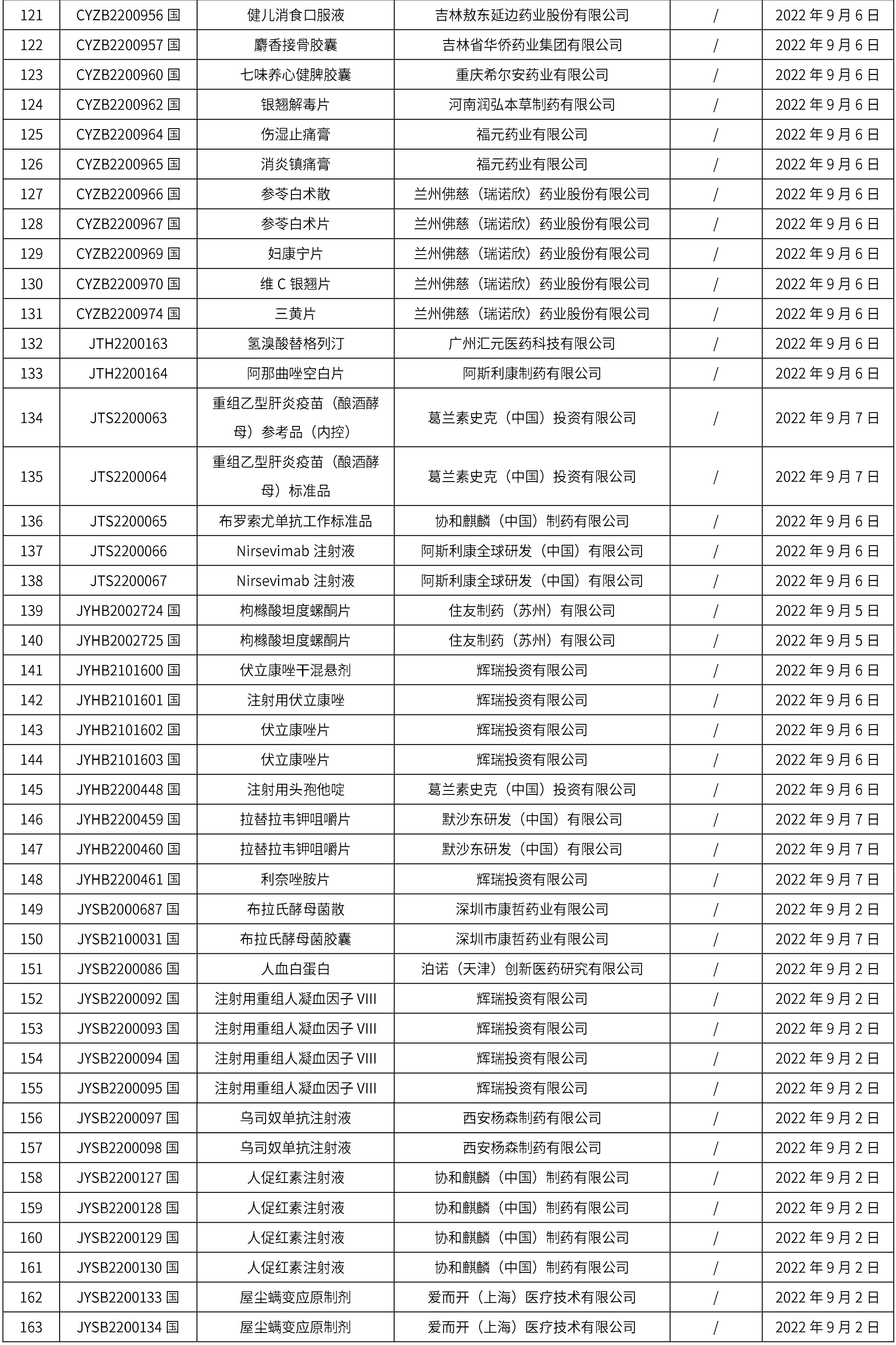
1. 本周(截止到9月16日12:18)共发布了163个品规的药品批准证明文件待领取信息,其中一致性评价14个,注射剂41个。

02
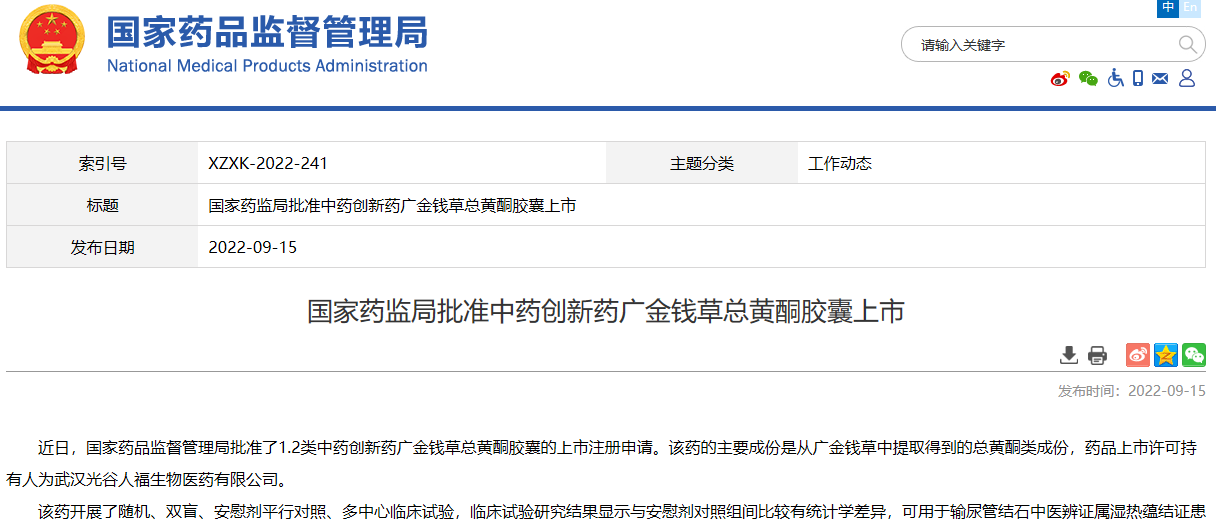
国家药监局批准中药创新药广金钱草总黄酮胶囊上市
扫描识别图中二维码
查看详细信息

03
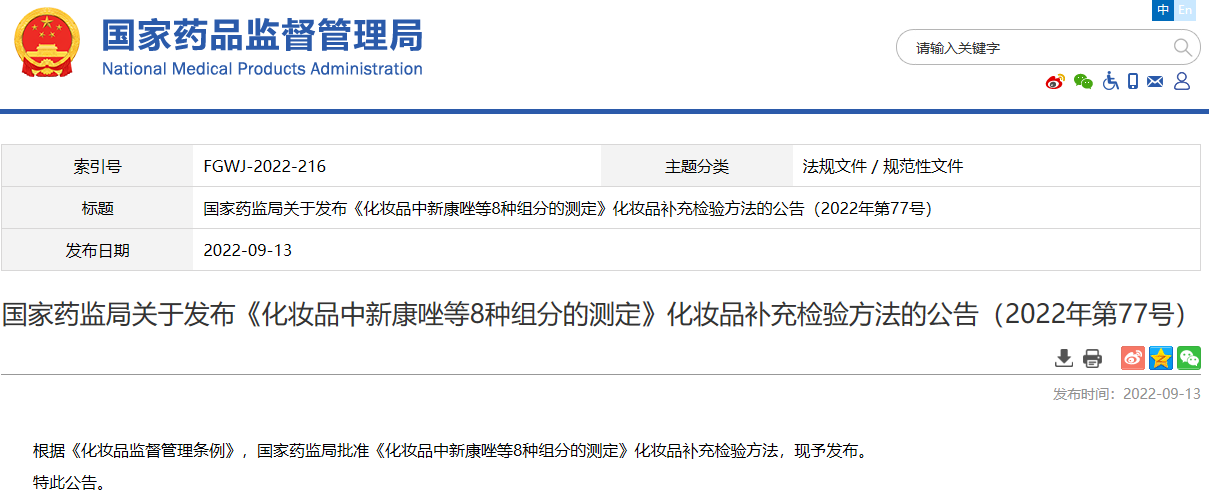
国家药监局关于发布《化妆品中新康唑等8种组分的测定》化妆品补充检验方法的公告(2022年第77号)
扫描识别图中二维码
查看详细信息

04
国家药监局关于92项医疗器械强制性行业标准和在研项目转化为推荐性行业标准和在研项目的公告(2022年第76号)
扫描识别图中二维码
查看详细信息

05
国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见
长按识别图中二维码
查看详细信息

关于公开征求《血液制品生产现场检查指南(征求意见稿)》意见的通知
扫描识别图中二维码
查看详细信息

1. 本周发布6个国家药品标准草案的公示。

扫描识别图中二维码
查看详细信息

-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
