政策法规 || 关于扩大药品电子通用技术文档实施范围的公告(2025年第10号)(附法规概览1.13-1.24)
01
国家药监局关于扩大药品电子通用技术文档实施范围的公告(2025年第10号)
为加快推进药品电子通用技术文档(以下简称eCTD)在我国的实施进程,提升“互联网+药品监管”应用服务水平,现将扩大eCTD实施范围有关事项公告如下:一、在《国家药监局关于实施药品电子通用技术文档申报的公告》(2021年第119号)中eCTD实施范围基础上,进一步扩大实施范围,自2025年1月27日起,化学药品1类至5类的药物临床试验申请,化学药品2类、3类、4类、5.2类的上市许可申请,以及预防用生物制品和治疗用生物制品1类至3类的药物临床试验申请、2类和3类的上市许可申请,可按照eCTD进行申报。二、采用eCTD进行申报的,申请人按照现行的eCTD技术文件要求准备和提交eCTD电子申报资料。鼓励采用网络传输方式提交eCTD电子申报资料,具体操作请参考国家药品监督管理局药品审评中心网站《关于试行以网络传输方式提交药品注册电子申报资料的通知》。

扫描图中二维码
查看详细信息

02
国家药监局综合司关于印发2025年药品检验能力验证计划的通知
根据《国务院办公厅关于全面加强药品监管能力建设的实施意见》(国办发〔2021〕16号)和《国家药监局综合司关于加强和改进药品检验检测能力验证工作的通知》(药监综科外〔2020〕67号)要求,为提升药品、医疗器械、化妆品检验机构能力和水平,国家药监局组织制定了2025年药品检验能力验证计划,该计划由中国食品药品检定研究院负责组织实施。
扫描图中二维码
查看详细信息

03
国家药监局药审中心关于发布《放射性治疗药物申报上市临床风险管理计划技术指导原则》的通告(2025年第5号)
为进一步明确放射性治疗药物上市后如何进行临床风险管理,本指导原则将针对上市后临床风险管理计划、说明书中安全性相关内容、患者指导手册的撰写提供具体指导意见。

扫描图中二维码
查看详细信息

04
国家药监局核查中心关于发布《清洁验证技术指南》的通告
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第八十九批)。为指导和规范药品上市许可持有人、药品生产企业(含原料药登记人)等对药品生产设备及部件清洁验证的科学管理,有效降低药品生产过程中污染与交叉污染风险,核查中心组织制定了《清洁验证技术指南》。
扫描图中二维码
查看详细信息

05
国家药监局核查中心关于发布《细胞治疗产品生产检查指南》的通告
为指导检查员开展细胞治疗产品生产环节检查工作,进一步加强细胞治疗产品生产质量管理,国家药监局核查中心组织制定了《细胞治疗产品生产检查指南》。
扫描图中二维码
查看详细信息

01
国家药监局关于中药保护品种的公告(延长保护期第20号)(2025年第9号)

扫描图中二维码
查看详细信息

02
中药保护品种公告(第22号)(2025年第8号)
扫描图中二维码
查看详细信息

03
国家药监局关于修订天麻制剂、复方石韦胶囊(颗粒、咀嚼片)和喘舒片等药品说明书的公告(2025年第6号)

扫描图中二维码
查看详细信息

01
国家药监局药审中心关于发布《预防用mRNA疫苗非临床研究技术指导原则》的通告(2025年第7号)

扫描图中二维码
查看详细信息

02
国家药监局药审中心关于发布《疫苗说明书临床相关信息撰写指导原则(试行)》的通告(2025年第9号)

扫描图中二维码
查看详细信息

03
国家药监局药审中心关于发布《预防用猴痘疫苗药学研究技术指导原则(试行)》的通告(2025年第8号)

扫描图中二维码
查看详细信息

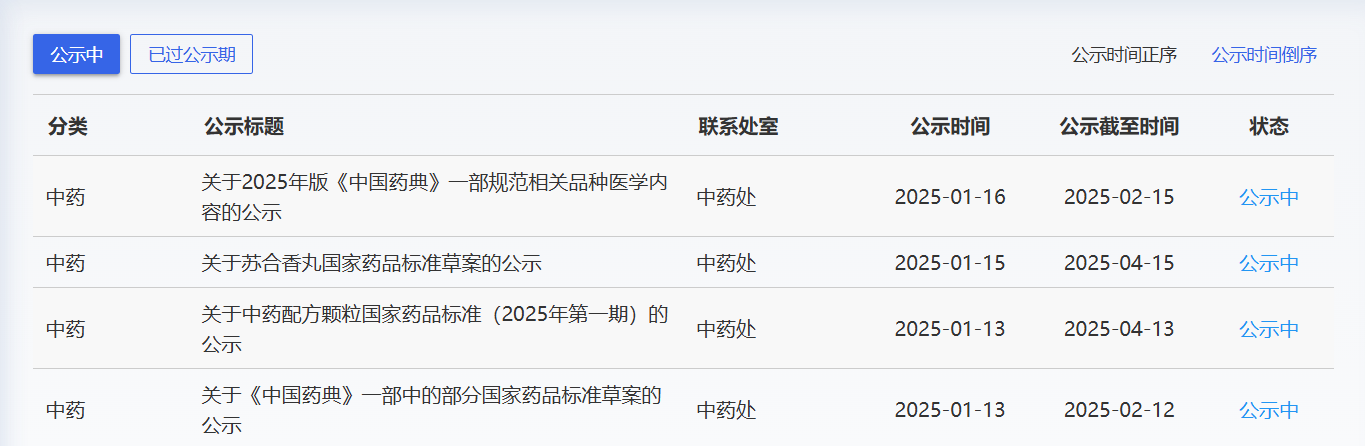
近期,药典委发布的标准草案公示如下:
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-83057670
Hotline服务热线:010-83057670
 简体中文
简体中文

 010-83057670
010-83057670 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
