政策法规 || 《药品上市许可持有人安全性评价技术指导原则》(附法规概览8.18-8.22)
01
关于发布《药品上市许可持有人安全性评价技术指导原则》的通知
点击下方链接
查看详细信息
https://www.cdr-adr.org.cn/drug_1/zcfg_1/zcfg_zdyz/202508/t20250818_51232.html
01
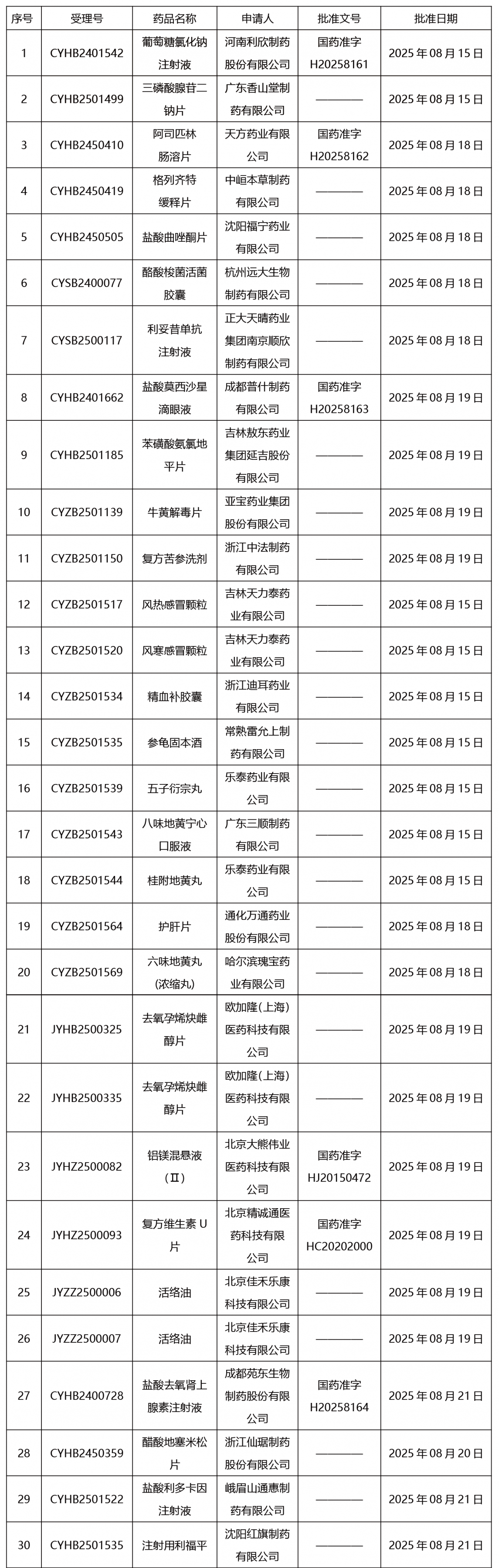
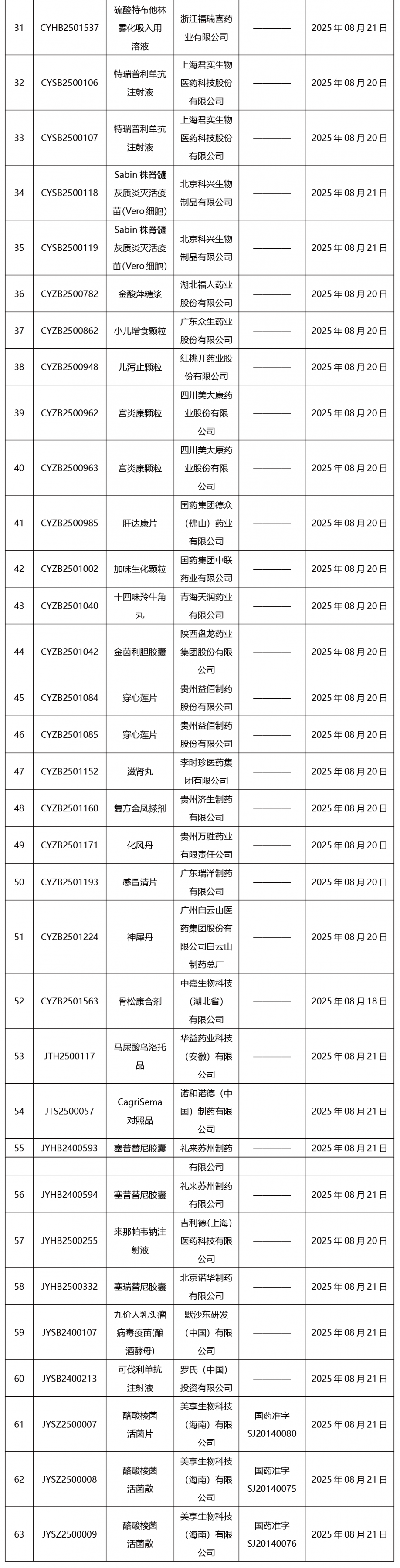
本周发布63项待领取药品批准证明文件。
02
2025年8月21日中药品种保护受理公示

点击下方链接
查看详细信息
https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20250821142508116.html
01
关于公开征求《药物临床试验利益相关性声明(试行)(征求意见稿)》意见的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/8bc9e3c770557139c5f3d463cc26d3b5
02
关于公开征求《单臂临床试验用于支持抗肿瘤药物常规上市申请技术指导原则(征求意见稿)》意见的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/90535766bf5cdad4590285791f35e197
03
关于将ICP-723口崩片纳入《儿童抗肿瘤药物研发鼓励试点计划(星光计划)》试点项目的公示

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/e8616987d14b6039fc492dbfdd7f9ab0
01
关于发布《药品上市许可持有人安全性风险沟通技术指导原则》的通知
点击下方链接
查看详细信息
https://www.cdr-adr.org.cn/tzgg_home/202508/t20250815_51231.html
ADR
01
关于发布《真实世界数据支持药品安全性主动监测的一般原则》的通知
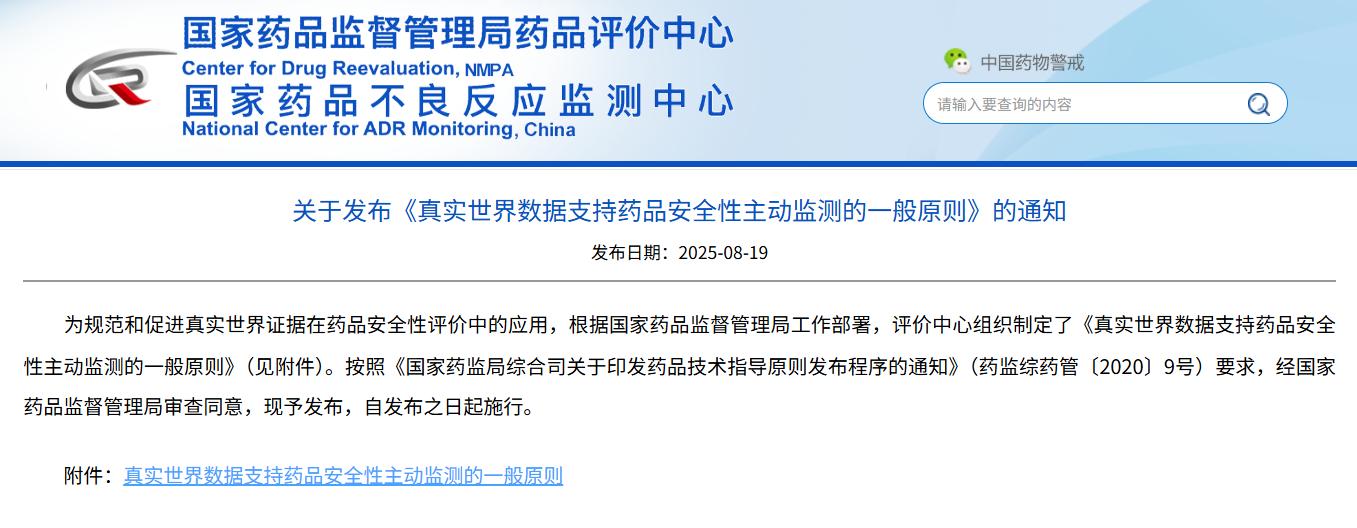
点击下方链接
查看详细信息
https://www.cdr-adr.org.cn/tzgg_home/202508/t20250819_51233.html
近期,药典委发布的标准草案公示如下:
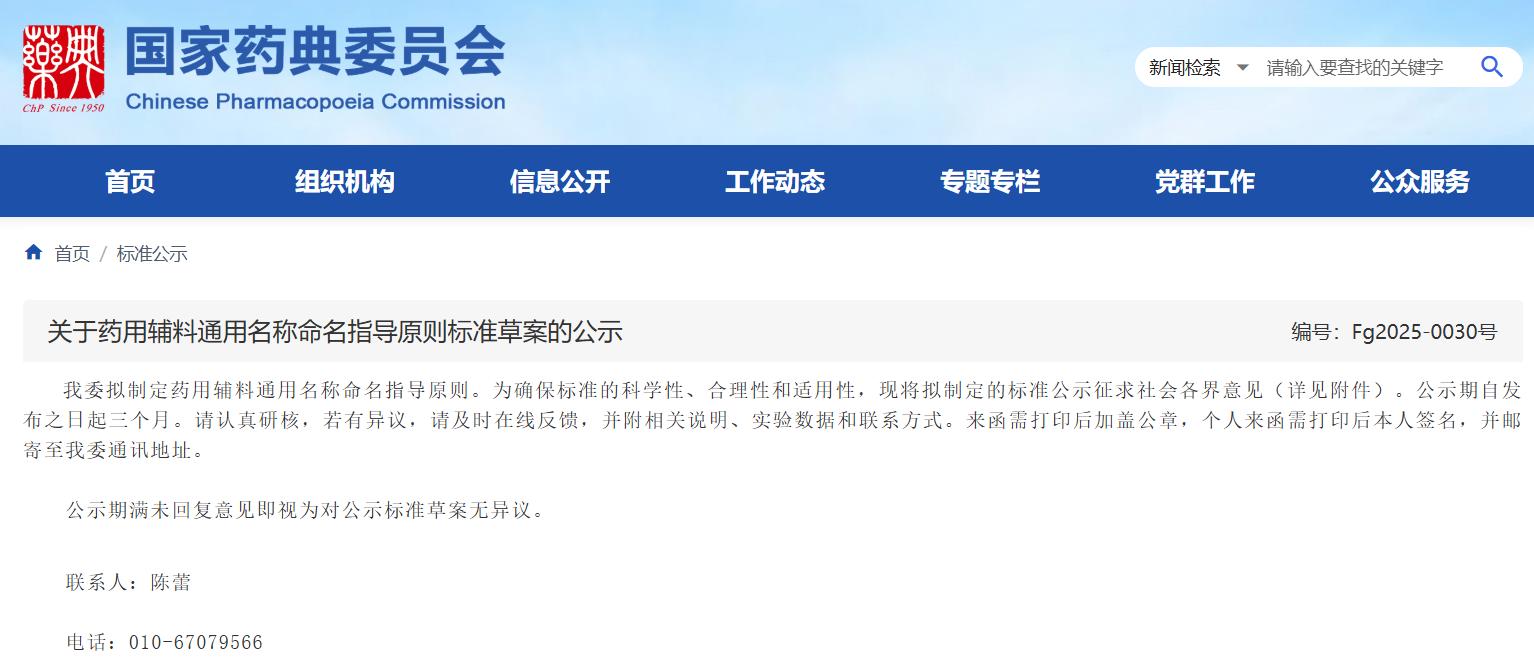
点击下方链接
查看详细信息
https://www.chp.org.cn/#/business/standardDetail?id=6899b10dbd8c75c5fa94bd4e
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-83057670
Hotline服务热线:010-83057670
 简体中文
简体中文

 010-83057670
010-83057670 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
