政策法规 || 《药物研发及申报临床常见问题技术指导原则(征求意见稿)》(附法规概览11.17-11.21)
01
关于公开征求《药物研发及申报临床常见问题技术指导原则(征求意见稿)》意见的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/17b37729742949c6198d8faa4a018b85
02
国家药监局关于发布仿制药参比制剂目录(第九十八批)的通告(2025年第40号)
点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20251118150906125.html
03
国家药监局综合司关于启用新版《药品生产许可证》《放射性药品生产许可证》样式的通知

点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20251121174208105.html
04
国家药监局关于发布药品生产企业出口药品检查和出口证明管理规定的公告(2025年第113号)
点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20251121163558131.html
CDE
01
关于将盐酸阿思尼布片/胶囊装微片纳入“儿童抗肿瘤药物研发鼓励试点计划(星光计划)”试点项目的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/fb19af26d45b5e21358dc634eb940c19
02
关于举办ICH Q5A(R2)指导原则及生物制品病毒安全专题培训的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/2d2970bb42700d210c79d511501babd6
01
国家药监局关于深化化妆品监管改革促进产业高质量发展的意见
点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/ggtg/hzhpggtg/jmhzhptg/20251117143349149.html
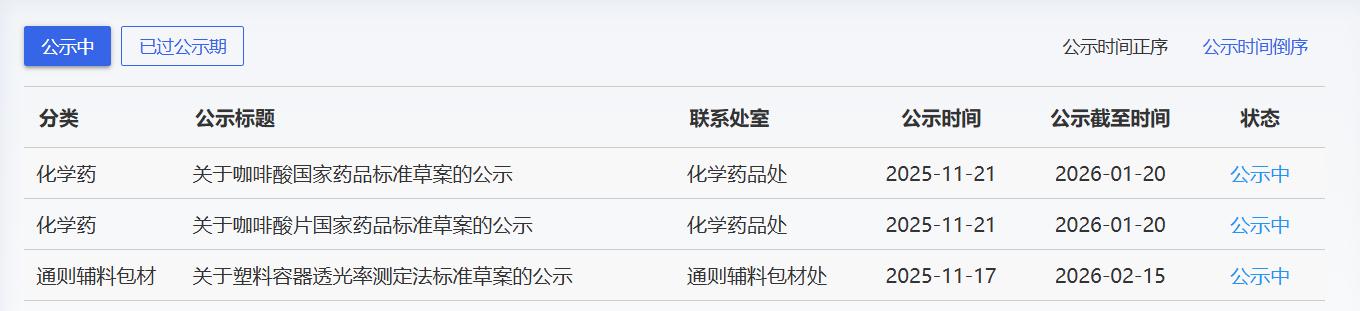
近期,药典委发布的标准草案公示如下:
点击下方链接
查看详细信息
https://www.chp.org.cn/#/business/standard
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-83057670
Hotline服务热线:010-83057670
 简体中文
简体中文

 010-83057670
010-83057670 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
