政策法规 || 关于2025年版中国药典二部凡例的公示(附法规概览09.09-09.20)
01
关于2025年版中国药典二部凡例的公示
国家药典委修订了2025年版中国药典二部凡例。
扫描图中二维码
查看详细信息

02
关于公开征求ICH《M13A: 口服固体速释制剂的生物等效性》(含问答文件)实施建议和中文版意见的通知
为推动ICH指导原则在国内的平稳落地实施,CDE拟定了《M13A指导原则(含问答文件)实施建议》,同时组织翻译了M13A指导原则(含问答文件)的中文版。

扫描图中二维码
查看详细信息

03
关于公开征求《生物类似药药学相似性研究的问题与解答(征求意见稿)》意见的通知
为进一步指导和规范生物类似药的药学相似性研究,CDE组织起草了《生物类似药药学相似性研究的问题与解答(征求意见稿)》。

扫描图中二维码
查看详细信息

04
国家药监局关于修订小儿清热止咳制剂说明书的公告
(2024年第112号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对小儿清热止咳制剂说明书中的【警示语】【不良反应】【禁忌】和【注意事项】进行了统一修订。
扫描图中二维码
查看详细信息

05
国家药监局药审中心关于发布《地舒单抗注射液生物类似药(肿瘤适应症)临床试验指导原则(试行)》的通告(2024年第38号)
为鼓励新药研发,在国家药品监督管理局的部署下,药审中心组织制定了《地舒单抗注射液生物类似药(肿瘤适应症)临床试验指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布。

扫描图中二维码
查看详细信息

06
发布《治疗慢性心力衰竭药物临床试验技术指导原则》的通告
慢性心力衰竭是一种严重的、慢性进展性、致死性的临床综合征,是心血管疾病的终末期表现和最主要的死因,目前仍缺乏有效的治疗药物。为了鼓励该领域药物创新研发,提供技术指导,药审中心组织制定了《治疗慢性心力衰竭药物临床试验技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布。

扫描图中二维码
查看详细信息

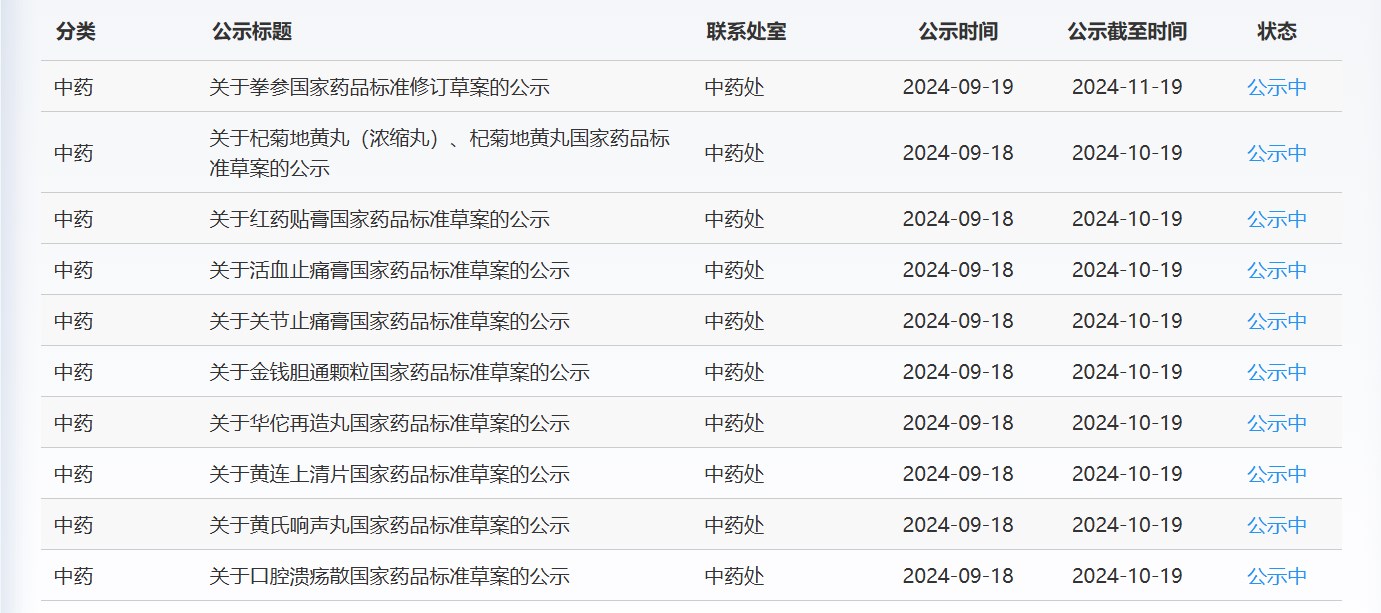
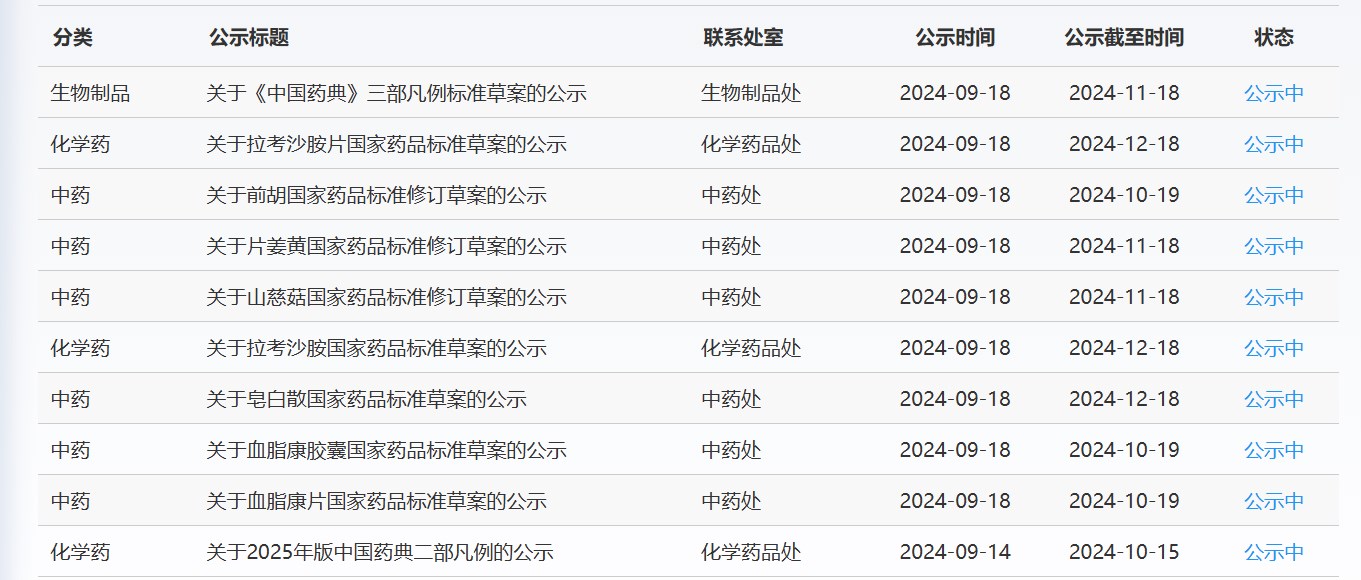
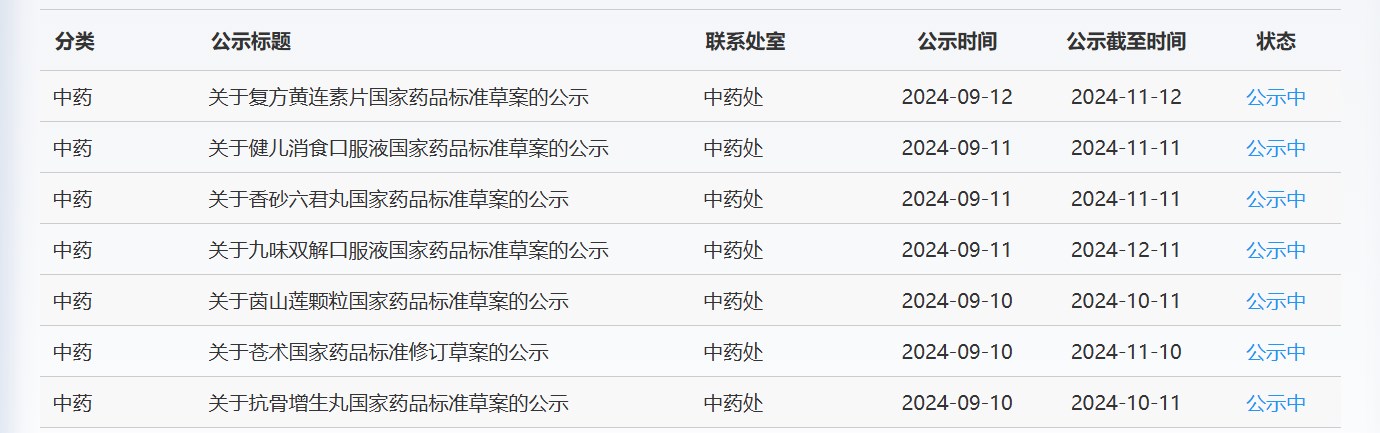
近期,药典委发布的标准草案公示如下:
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-83057670
Hotline服务热线:010-83057670
 简体中文
简体中文

 010-83057670
010-83057670 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
