原料药、制剂工艺和质量研究的辩证统一
从2016年3月5日(国务院办公厅关于开展仿制药质量和疗效一致性评价的意见)至2020年5月14日(CDE发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等3个文件的通告),明确了注射剂一致性评价的执行期限、技术要求及申报资料模板;从2019年6月13日(第21批参比制剂目录)至2020年5月19日(第29批参比制剂目录),共公布374个品种注射剂(占市场注射剂品种的21%),895个品规,参比制剂的选择也日渐明确。
从各企业注射剂一致性评价受理号排行(图1)及最受欢迎的注射剂品种可以看出,齐鲁制药、扬子江、四川科伦、江苏恒瑞、宜昌人福、江苏豪森以及正大天晴注射剂的受理号均超过了20个。另外,在最受欢迎TOP10名单中,以抗炎抗感染类大容量品种最受大家青睐,竞争激烈。
截止到今年4月22日,已经有32个品种的注射剂通过或视同通过了一致性评价,其中粉针剂和水针剂市场占比约为80%,是我们研究和关注的重点。

注射剂一致性评价的主要工作模块及案例分享:
今天我们就来聊一聊注射剂一致性评价研发过程中的几个关键环节,帮大家填坑!
参比剖析、原辅包筛选、工艺研究和相容性研究四个环节的关系如下图。几个环节既相对独立,又相互关联,是相辅相成、辩证统一的关系。
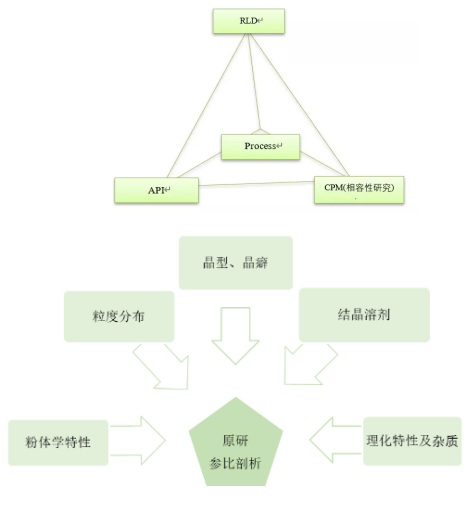
(一)原料药
原料药的质量是注射剂一致性评价的最关键因素,尤其是对于无菌分装类产品,那么我们应如何选择符合要求的原料药呢?

案例分享:
下面,我们以某头孢品种为例,讲述一下原料筛选的流程。
- 晶型——XRD

结果:厂家1和2的原料药晶型与原研制剂是比较一致的。
- 溶解时间
结果:溶解时间与原研略有差异,可能存在晶型、粒度分布及晶癖方面差异。
- 晶癖
结果:随着电镜扫描放大倍数的增加,可以更加清楚地看出原料药和原研制剂的差异:原研制剂的颗粒明显小于原料药,而厂家1原料药的表面更加紧实,所以溶解时间也会更长。
- 粒径分布
粒径方面,各个厂家的原料药的粒径均大于原研参比,从侧面说明,为什么各厂家原料药的溶解时间均较原研长。
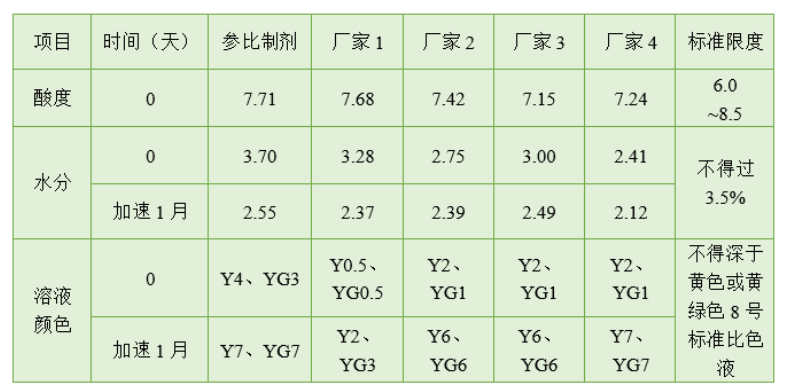
(5)其他理化指标
结果:各个厂家原料药的品质与原研制剂没有太大差异,说明原料药的成盐工艺与原研制剂是比较接近的。
(6)杂质分析
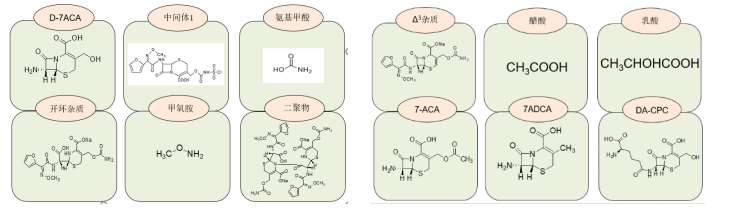
在做杂质分析时需要重点关注三个方面,也是目前发补最多的部分:遗传毒杂质,元素杂质,残留溶剂。
我们根据原料药的生产工艺及β-内酰胺类抗生素的特点,重点研究了以下杂质:
通过上述案例分析,我们归纳总结出原料药的筛选过程如下:(1)首先,我们要找合规的、有资质的原料供应商;(2)考虑成本及其是否可以持续供货;(3)原料药剖析并与原研进行对比。
(二)辅料
在辅料种类和用量的选择方面,主要是根据原研药说明书、专利调研情况、反向剖析结果以及常规用量来确定的。部分注射剂中含有有机溶剂,对原料药起到助溶作用,但有机溶剂的含量往往会影响澄清度和晶型。
案例分享:辅料用量
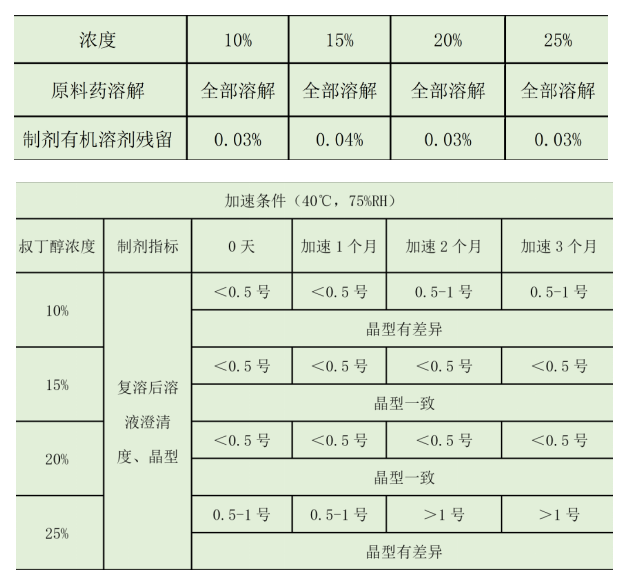
在选择叔丁醇作为辅料的时候,它在稳定性期间,对制剂的澄清度是有影响的。所以我们对辅料的用量进行了考察:
结论:试验结果表明,辅料叔丁醇的浓度对制剂的有机溶剂残留没有明显影响,但是对溶液的澄清度和复溶后原料的晶型有较为明显的影响。最终确定15%和20%的辅料浓度是比较合适的。
(三)生产工艺
工艺同样影响着制剂的稳定性。
案例分享:某制剂有两种辅料,通过测试两种辅料的不同添加方式,来优化制剂生产工艺。见下表:
结论:试验结果证明,不同的加料顺序对制剂的有关物质有明显影响,按照参比制剂辅料用量加入A和B,杂质增加明显且辅料A有明显的剩余。在95%-105%范围内调整辅料用量,并且对物料的加入方式进行深度研究,以独特的加料方式降低杂质的增加,使其符合一致性评价要求。
(四)包材
案例分享:该制剂对水分比较敏感,制剂在加速条件放置过程中,有关物质及溶液的澄清度和颜色变化明显,经排除原料药和辅料等其他因素,最终确定为包材对其影响。
胶塞水分的控制

胶塞水分对制剂稳定性的影响

结论:从上表可以看出,胶塞水分对制剂稳定性有显著的影响。实验室在冻干过程当中,除了对制剂自身水分进行控制外,采取非常规胶塞处理方式控制胶塞的水分,从而降低胶塞水分迁移对制剂质量的影响。
注射剂一致性价过程中的质量提升与技术创新
如何精准而高效地进行注射剂质量一致性评价,既不过度研究杂质,又要保证研究的充分,在两者之间找到一个平衡点,是值得我们大家思考和关注的问题。为应对越来越严格的审评要求,我们必须在包材相容性研究、遗传毒杂质检测、聚合物定量和结构鉴定等领域进行质量提升与技术创新。下面我们就从这三个方面的研究来进行经验分享。
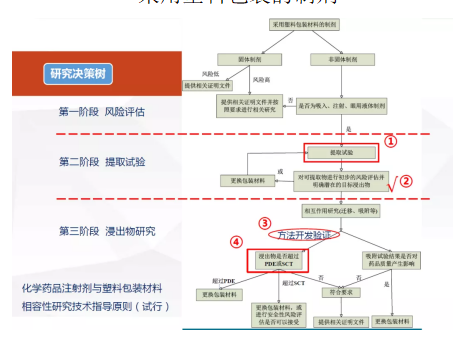
(一)相容性研究
做包材相容性研究的时候,首先要确定整体研究思路,我们主要参照以下决策树来进行方案的制定和计划的实施。
采用塑料包装的制剂

采用玻璃包装容器的制剂

总结以上策略,我们不难看出,风险评估是相容性研究最重要的环节。所以,在做包材相容性研究前,一是要对包材的型号、材质、在生产过程中的使用步骤、使用前的预处理方式、与药液的接触条件(如接触时间、温度等)等情况进行汇总整理;二是对供应商/生产商进行审核并提交相关支持文件,如生产商质量保证体系(如ISO、GMP)、配方(尤其添加剂种类和用量)和加工工艺、产品符合性声明(USP/EP/21CFR等)、检验报告和供应商的验证资料等,对包材质量及其生产商的质量保证体系进行全面评估,优先选用标准符合性好、质量保证体系完善的包材。
同时,结合不同给药途径的风险分级以及制剂与包装组件发生相互作用的可能性进行评估,来确定最终的研究方案。
风险分级
(二)遗传毒杂质检测策略
遗传毒性杂质的限度大多都很低,对检测的灵敏度要求很高,因此需要使用气质和液质等设备,导致检测成本的升高。如何在节省资源和提高研究效率的基础上保证遗传毒性杂质研究的充分性,我们根据专家的意见,使用Derek&Sarah软件等高科技手段作为解决方案。其中,Derek软件是基于专家知识系统,对化合物的毒性进行预测;Sarah是一种基于统计学模型来预测化合物致突变性的软件。这两个软件相结合,就可以对一些具有遗传毒性警示结构的化合物进行风险评估,决定其研究方案和策略。
(三)技术创新
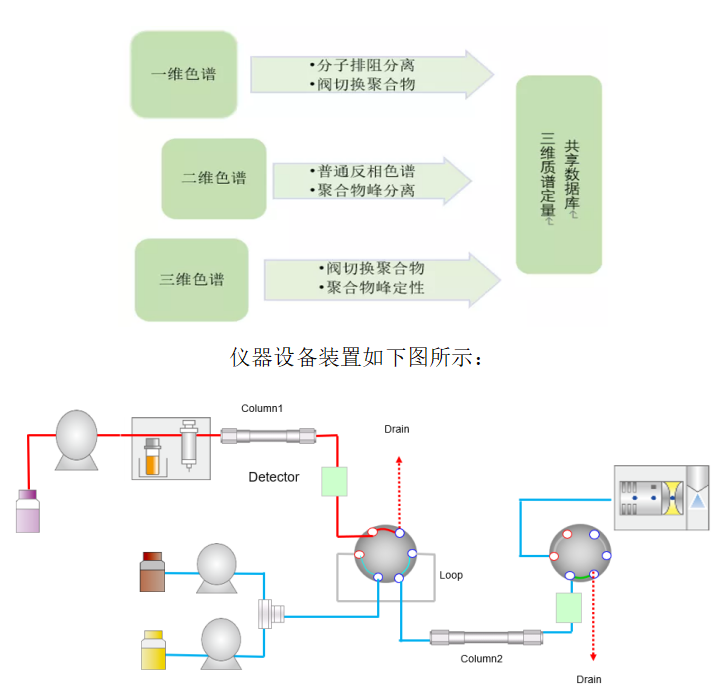
高分子聚合物是引发β-内酰胺抗生素速发型过敏反应的过敏原, 研究聚合物是抗生素质量控制的重点之一。目前常用凝胶过滤色谱法(分子排阻色谱法)、离子交换色谱法、反相色谱法、毛细管电泳法检测聚合物, 其中以凝胶过滤色谱法为主。
近年来,也有用液质联用技术检测聚合物的报道,但只能检测聚合物杂质总量,无法分离和鉴定单个聚合物的结构,更无法对每个聚合物进行定量。我们与岛津公司质谱创新中心建立了联合实验室,合作开发出三维色谱技术,对聚合物进行了分离和结构鉴定。为企业改进工艺、剂型研发、品质提升提供技术参考,保障患者用药安全。同时也可为提升药典标准提供科学依据。
仪器设备装置如下图所示:
多维色谱,Q-TOF定性
新领先与岛津联合实验室已经开展10余个抗生素类药物聚合物杂质的研究工作,今后还会继续这方面的合作。目前聚合物结构的数据库正在建立中,期望今后与同行进行数据和成果分享。
关于我们:
液体制剂事业部现有研发人员80余人,近80%为硕士或博士学历。由具有10年以上国内外项目管理、药品开发及生产转化经验人员作为主要研究及管理者,形成从具有集产品立项、处方工艺开发、质量全面研究、工艺产业化、稳定性研究及注册申报于一体的药品研发全产业链架构。
事业部配备液体制剂开发所必备的成熟国际知名品牌的生产和检测设备。分析检测仪器包括卡尔费休水分测定仪、不溶性微粒检测仪、澄明度检测仪、自动表/界面张力仪、顶空气体分析仪、数显粘度计、马尔文激光粒度仪、渗透压测定仪、呼吸模拟器、新一代药用多级撞击器、医用压缩/超声雾化器、溶解氧测定仪以及HPLC/UPLC/LC-MS/ICP-MS/GC/GC-MS等色谱、质谱或联用等仪器。工艺开发及放大设备主要包括不锈钢配制罐(具有加热和冷却功能)、囊式过滤器、安瓿熔封机、东富龙0.25㎡冻干机以及湿热全自动高压灭菌仪柜(可打印曲线及F0值)、密封性测试仪、多功能瓶盖锁口机、低温超高压均质机、真空手套箱等,可满足实验室研究及中试规模放大验证使用,实现从实验室研究至放大生产的零风险过渡。
转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
