无参比制剂,不降低技术审评标准!药学研究如何才能抢占先机?
无参比制剂,不降低技术审评标准!药学研究如何才能抢占先机?
随着《化学药品注射剂仿制药质量和疗效一致性评价技术要求》的正式实施,化学仿制药一致性评价工作进入攻坚阶段。一致性评价像是一场企业间的百米赛跑,在这场近乎“白热化”的追逐赛中,谁将拔得头筹,明确开发思路就显得尤为重要。
2020年8月27日,CDE发布《临床价值明确,无法推荐参比制剂的化学药品目录(第一批)(征求意见稿)》(以下简称《目录》),该目录涉及注射剂40个、片剂25个、散剂3个、颗粒剂4个、胶囊剂4个、口服溶液10个,及其他剂型产品共计117个品种。

《目录》一经公示,药企瞬间将注意力转移至该类品种,相较于往常的一致性评价,目录中的品种参比制剂不明确,现已有批准文号的产品一致性评价工作如何开展、如何申报、审评标准?本文将结合目前政策法规动向以及本人10多年的研发经验,略谈对于参比不明确品种的研发思路。(讨论基于现行技术指导原则,后续如果有针对这类产品新的法规原则再讨论)
无参比制剂,不降低技术审评标准
我们需要明确,不推荐参比制剂不等于不设定评价标准,不等于不需开展再评价。除无需与参比制剂对比外,所有技术标准均以现行规章、指导原则及药典标准为依据。可以说没有参比制剂作对比,就意味着企业需执行最严标准。
《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中指出,无需开展一致性评价的品种需进行质量提升研究。随后,在国家药监局对于《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》政策解读中指出,对临床价值明确但无法确定参比制剂的化学药品注射剂仿制药无需开展一致性评价。仿制药一致性评价办公室将组织专家委员会进行梳理,分期分批发布此类品种目录,鼓励MAH按照注射剂相关指导原则开展药品质量提升相关研究,并按照药品上市后变更管理有关规定申报,执行一致性评价的审评时限。
此“鼓励”一出,对于已有批文的品种指明方向,无参比是不可以原地踏步,标准需提升,质量需可控,进而提升药品的安全性、有效性。企业主动出击,可按照《已上市化学药品生产工艺变更指导原则》《已上市化学药品药学变更指导原则》等为依据,开展相关研究工作,并以变更相关规定进行申报,走在前面一定会抢占市场先机。
相关研究工作如何开展?现作者就从以下几个角度予以拙见,望对同行有所启发。
原辅包关联
“同在屋檐下,差距不能有”。MAH应该关注现产品所使用的原辅料包在CDE登记平台是否有登记且对应的产品信息和研究资料能够有效保障制剂质量,以满足关联审评的技术要求。对于未登记或产品质量无法保障制剂质量的,可要求其原辅包供应商按照最新指南及相关要求进行标准提升后再进行登记,或可选用已登记的原辅包,同时要求原辅包供应商提供授权使用书,并按照相关变更分类进行补充研究工作。
药学研究工作
对于药学研究工作,主要参考其对应剂型相关的指南、技术指导原则和参考标准进行研究。以注射剂及咀嚼片为例阐述相关药学提升研究内容。
- 原辅料的控制
对于水针注射剂,除原料药外,一般选择水作为溶剂,氮气作为保护气。
✎对于原料药:应重点关注杂质限度制定合理性,元素杂质、致突变杂质研究的完整性和充分性,修订原料药内控标准,有效做到源头控制。
✎对于辅料:溶剂水应明确水来源及根据各国药典情况明确和修订执行标准;对于工艺使用气体氮气,应参考《无菌验证GMP实例指南》和国外药典(如EP)制定合理的氮气内控标准。
✎对于包材:应对直接接触药品内包材除热原方法进行验证或与供应商接洽要求其出具的相关证明资料,以保证产品的细菌内毒素可控。
- 处方工艺的完善确认
若工艺描述过于简单,不利于省局及国家局的有效监管;另外,对于企业内部产线变更或人员变更的有效重现可控性差。再注册的相关技术标准亦在提升,企业需按照《化药生产工艺及质量标准通用格式》应明确相关工序的具体操作参数和描述,对于需要给出工序时限的应进行相应的补充研究或验证;按照注射剂相应技术要求进行质量提升研究工作。如:
2.1灭菌工艺的验证
1)药品终端灭菌工艺验证;
2)直接接触药品的内包材的除热原验证或供应商出具的相关证明资料;
3)包装系统密封性验证,方法需经适当的验证;
4)灭菌装载方式、装载量,空载和满载热分布实验;
5)灭菌前药液微生物负荷进行放宽频率的检测;
6)保持时间(含化学和微生物)验证。
2.2配液工艺的验证
1)配液明确配液搅拌速度;
2)配液明确配液搅拌时间。
2.3过滤
1)过滤的压力、速度、温度考察和确认;
2)滤器使用个数及更换频次(如重复使用,需提供相关的支持性验证资料)。
2.4密封性验证
1)参考USP<1207>等相关技术要求合理设计试验进行密封性验证,特别注意阳性对照样品的设置及对检测方法灵敏度的考察;
2)以微生物调整试验作为金标准验证所选择的生产过程所采用的检漏方法;
3)商业化生产采用的密封性检查方法验证。
2.5相容性试验
1)参考USP PF665/1665、《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》《化学药品与弹性体密封件相容性研究技术指导原则(试行)》《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》及《ICH Q3D元素杂质指导原则》等技术要求,基于风险评估,完善生产中所用塑料组件系统(如密封件)及包材相容性研究;
2)依据《药品生产质量管理规范》(2010年修订)相关法律法规和指南要求(无菌药品分册P252-P254)及《除菌过滤技术及应用指南》《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》注射剂开发过程中需要进行药液与滤芯相容性验证;
3)依据《YY/T 1550.2一次性使用输注器具与药物相容性研究指南第 2 部分:可沥滤物研究已知物》《YY/T 1550.2 一次性使用输注器具与药物相容性研究指南》《一次性使用避光输液器注册技术审查指导原则(征求意见稿)》《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》《化学药品与弹性体密封件相容性研究技术指导原则(试行)》及《ICH Q3D 元素杂质指导原则》等相关技术指导原则开展给药装置相容性研究。
……
- 质量标准的提升
无需推荐参比制剂并非不选择参照药物,可选择国际主流国家如欧美日或国内市场/临床流通量大的多来源制剂作为参照样品,对其进行关键质量属性的考察,并结合对应的指导原则拟定可有效控制自行生产制剂的质量标准。
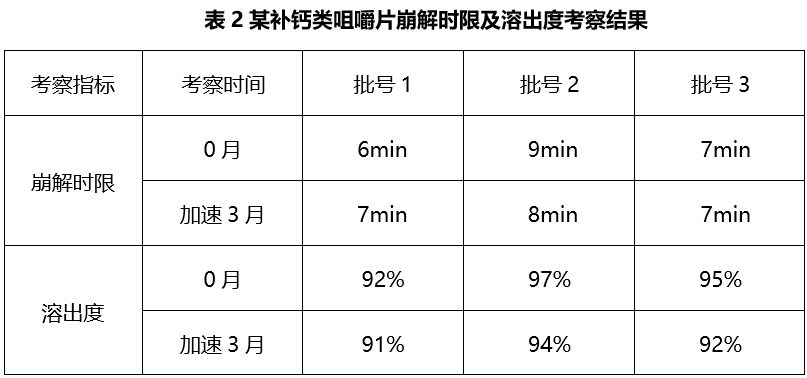
如对于《目录》中的咀嚼片类品种,中国药典通则中未对其崩解时限及溶出曲线作硬性规定,且各国药典收载标准亦未将溶出度列入其质量标准。某补钙类咀嚼片,研究人员对主流国家上市的不同批次对照制剂进行崩解时限及溶出度考察,结果表明崩解时限和溶出度的批间差异较大,六批对照制剂的崩解时限在7~30min不等,在盐酸介质中30min溶出度在36%~97%不等,相关数据见表1。

FDA发布的咀嚼片关键质量属性指导原则中提出:



为有效的控制自制品的批间均一性及货架期间稳定性,为生产参数的制定提供依据,同时保证咀嚼片在临床使用期间由于部分人群咀嚼不完全导致临床疗效的差异,故推荐按照普通速释片的崩解时限及溶出度标准确定咀嚼片的控制标准。参考USP<2040>相关规定将某补钙类咀嚼片内控崩解时限拟定为不得过30min,参考USP同品种普通速释片剂将在盐酸介质中30min的溶出度拟定为不得过75%。对多批次自制品进行考察,结果见表2。
临床研究是否需开展
对于《目录》中收载的品种是否需要进行临床试验,目前并无与本目录相匹配的法规。但在该目录的备注列出“未在国内上市品种,需参照原总局2015年第230号公告等相关要求开展研究,药品通用名称、剂型经药典委核准后为准”。根据230号公告要求,未能与原研药进行对比研究的,应按照创新药的技术要求开展研究。据此我们可合理推测,对于临床上存在的超说明书使用现象或该品种被批准上市时未进行完整而严格的临床研究的情况,不排除进行临床有效性试验的可能性。
综上,对临床价值明确但参比制剂不明确的品种,无论是以化药4类还是一致性评价开展,都需先进行充分的调研,以确定是否开展临床研究以及市场价值;在进行药学研究的时候,参考现行指导原则、各国质量标准,同时辅以同品种对比研究,即可明确开发思路。需要说明的是,无参比制剂可作标杆,这类品种的质量标准及相关工艺参数需从严,以更好地满足审评审批的要求。
在这场极速前进的赛跑中,提前进行战略布局,明确研发思路,抢占市场先机,方可拔得头筹,笑傲江湖!
关于我们:
药政部是隶属于公司副总裁直接领导下的部门,以国家药品政策为导向,以为客户提供集药物研发、注册申报、现场核查等一体化专业技术服务为宗旨,以高效、成功申报项目为最终目标。
药政部拥有一支技术与注册经验丰富的团队,作为一家提供专业服务的公司,在原料药登记、仿制药一致性评价、仿制药注册、新药注册以及进口药品注册等方面均具有专业且丰富的经验,已助力成功申报多项药品注册申请,在业内具有良好的口碑。
部门坚持 “忠诚、思考、建设、承担、分享”的公司理念,不断加强人才队伍建设、提升专业能力、丰富注册经验、拓展业务范围,致力于为客户提供高效率、高质量、合规的技术服务,为保护和促进公众健康而不懈努力。
转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
