惊喜解读-包装系统相容性研究
《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》[1]中明确提出注射剂需开展包装材料和容器的相容性研究。同时公众对药品的安全意识也在不断加强,对由包装系统引发的安全性问题关注度也日益增加,各国也出台了相应的法律法规及指导原则。《化学药物注射剂与塑料包装材料相容性研究技术指导原则(试行)》[2]、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》[3]、《化学药品与弹性体密封件相容性研究技术指导原则(试行)》[4]等。本文结合实际工作中的一些经验对相应指导原则进行了解读,可供大家借鉴。
包装系统是指容纳和保护药品的所有包装组件,包括直接接触药品的包装组件和起额外保护作用的次级包装组件。作为药品包装组件,一方面应满足包装系统对密封性的要求,为药品提供保护并符合包装预期的使用功能;另一方面还应与药品具有良好的相容性,即不可引入存在安全性风险的浸出物,或浸出物水平符合安全性要求,且不会因为吸附药品中的有效成分或功能性辅料,影响药品的质量、疗效和安全性。本文主要从相容性研究的过程和主要内容两个方面进行解读。

图1 包装系统相容性研究过程
❏ 确认包装系统各组件的法规符合性、质量标准符合性并获得证明性材料;
❏ 收集包装系统各组件的配方信息、加工助剂信息、清洗剂及清洗方式等基本信息,以便获得添加剂及引入杂质信息用于研究;
❏ 收集与药品相关的处方组成、关键工艺参数、规格、装量、储存条件、给药途径、给药方式和每日最大临床使用剂量等信息,以便确定提取条件及杂质研究限度。
根据包装系统和药品的特点,合理设计提取试验和/或模拟提取试验,方案需结合USP章节<1663>[5]、<1664>[6]、<660>[7]、<661>[8]中相关内容进行设计,对于存在多种包装规格相同材质的品种,宜首选比表面积最大的包装系统进行提取试验,对于不同包装材质或者不同来源的均需进行提取试验研究。参考 YBB00142002-2015《药品包装材料与药物相容性试验指导原则》[9]中相关要求,提取试验和/或模拟提取试验需对3批空包装系统进行研究。
❏ 采用适宜的溶媒、药品或模拟药品,选用一定的提取方式和提取条件,在较严苛的条件下,对包装系统各组件或整个包装系统进行提取试验和/或模拟提取试验,对包装系统各组件中的可提取无机物和有机物进行定性定量研究,用化学分析的方式进行初步风险评估,预测可能潜在的目标浸出物,并依据研究过程中获得已知可提取物的种类和水平信息,建立灵敏的、专属的分析方法,以指导后续的浸出物研究;
❏ 安瓿瓶和注射剂瓶需首先评估玻璃脱片风险,可参考《ASTM F 1980:2002无菌医疗器械包装的加速老化试验标准指南》[10],取0月的样品在加速条件下进行侵蚀实验,在短期内得到相当于长期条件的产品,同时用氢氧化钠溶液制备阳性对照样品,采用扫描电子显微镜(SEM)进行检测,同时关注 Si、B 和 Al 元素的变化趋势及突跃点,突跃点可能预示着较高的脱片风险。
采用所使用包装系统的拟市售包装的药品(3批)进行浸出物研究(迁移试验)。对浸出物的检测方法进行充分的方法学研究,确认检测方法可专属、准确、灵敏、稳定地检出浸出物。迁移试验一般可与药品稳定性研究一同设计,检测稳定性试验相应时间点药品中的浸出物,观察浸出物的变化趋势,对试验数据进行必要的统计分析和总结。
(注:吸附试验一般与药品稳定性试验同时进行,相容性研究可不再考察。)
采用列表的方式对可提取物和/或浸出物进行安全性评估,可采用PDE法、SCT或QT法、TTC法等计算有机物杂质限度,可采用结构活性数据库及互联网等毒理学参考文献获得数据进行毒性评估;可参考 ICH Q3C[11]、ICH Q3D[12] 和 ICH M7[13] 杂质评估思路进行杂质评估。
通过提取试验、模拟提取试验和迁移试验结果及安全性评估结果确定包装系统与药品是否相容,包装系统是否适用。
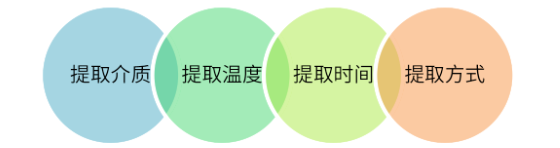
图2 提取试验设计
❏ 提取介质:纯化水、酸性缓冲溶液( pH 应不高于药品实际处方,一般选择 pH2.5 缓冲液)、碱性缓冲溶液( pH 应不低于药品实际处方,一般选择 pH10.0 缓冲液)、复溶后药液/药液(如活性成分干扰检测,可选择不含活性成分的空白制剂溶液)、乙醇水溶液(有机相比例应不低于药品实际处方,一般选择50%乙醇溶液)、正己烷或二氯甲烷(仅适用于气雾剂或特定用途);
❏ 提取条件(温度、时间):一般需考虑生产工艺中可能的加热因素,例如冻干工艺中最高温度下的持续时间、终端灭菌温度及持续时间、配液灌封过程中的最高温度及持续时间。一般选择40℃/60℃/121℃;30分钟/60分钟/12小时/24小时,可根据工艺特点选择试验设备,烘箱、震荡水浴槽或灭菌器;
❏ 提取方式:参考药品生产工艺信息及药品在生产、贮存、运输及使用过程中可能面临的最极端条件。一般采取剪碎浸泡震荡提取或整套装置震荡提取(可采用正立、倒置方式)。其中覆膜胶塞可根据其覆膜作用采用整个完整胶塞浸泡提取不进行剪碎处理。

图3 浸出物试验设计
❏ 试验条件:参考说明书中贮藏条件及品种特点,结合 ICH 指导原则和中国药典稳定性指导原则拟定稳定性放样条件,一般稳定的品种考察条件:
加速:40℃±2℃,75%±5%或30℃±2℃,65%±5%;
长期:25℃±2℃,60%±5%;
注意半渗透性材质需按照ICH指导原则拟定低湿度的考察条件;
❏ 试验时间:按照产品效期进行放样点设计,并增加高于效期点的放样点,一般按照加速3月、加速6月、长期6月、长期12月、长期24月、效期点、效期以上点。存在多规格的品种稳定性考察样品各规格均需检测,同时关注不同材质包装系统的放样方式,一般玻璃安瓿及半渗透材质可选择平放,注射剂瓶+胶塞可选择正立和倒置均放置(例如加速3月、加速6月、长期6月、效期点关键点均检测,其他常规放样点首选倒置方式样品进行检测,如杂质无明显变化同时考虑元素杂质的浸出风险较低,故可不再检测正立样品。
❏ 考察项目:通过提取试验、模拟提取试验(浸出物预试验)进行有机物及无机物评估,确定需继续进行浸出物研究的杂质。其中 Cd、Pb、As、Hg、Co、V、Ni、Li、Sb、Cu、Si、B、Al 13种元素需研究。
元素杂质使用 ICP-MS、ICP-OES、AAS 等仪器进行半定量和/或定量分析;有机物杂质使用 GC-MS、LC-MS、HPLC、IC、GC 等仪器进行半定量和/或定量分析。
参考中国药典指导原则 9101《药品质量标准分析方法验证指导原则》[14]进行方法验证:
✔ 半定量方法需进行系统适用性和灵敏度验证;
✔ 定量方法需进行专属性、灵敏度、线性和范围、精密度、准确度等验证。
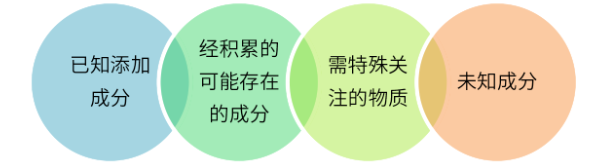
图4 可提取物和浸出物的评估分析
❏ 已知添加成分
✔ 从信息收集获得已知添加成分,通过文献调研获得人每日允许暴露量(PDE)进行半定量评估;
✔ 如无法获得 PDE 值可参考 ICH Q3C、ICH Q3D 和 ICH M7 等指导原则,通过 LD50、TD50、LOEL、NOEL 等数据进行转化得到评估限度。毒性数据可从结构活性数据库,如DEREK,ToxTree,LeadScope,CCRIS,HSDB,TOXNET,RTECS,TOXLINE CORE,TOXLINE SPECIAL,TOXBIO 和 TOXCAS,以及互联网等毒理学参考文献中获得。
❏ 经积累的可能存在的成分
由于弹性体的组成较复杂且存在较多的变更风险,故积累建立弹性体的可提取物数据库很有必要,评估思路同已知添加成分。
❏ 需特殊关注的物质
对于亚硝铵类、多环芳烃类、2-巯基苯并噻唑及指导原则中收录的需关注的物质建立经验证的方法进行定量分析,以保证特殊关注杂质在包装系统中质量可控。
❏ 未知成分
按照美国产品质量研究所(PQRI)[15]中推荐的非肠道途径产品的安全性阈值(SCT)为 1.5μg/天,界定阈值(QT)为 5μg/天,结合日服用最大药量计算得到分析评价阈值(AET),同时结合检测仪器的特点选择合适的内标进行半定量评估,对未知杂质进行分析鉴定,经鉴定可能有4种结果,确定的、可能的、不确定的、未知的,分别根据鉴定结果进行再评估。
06 安全性评估及结论
❏ 可提取物
✔ 对于不超过 AET 的可提取物,可界定该提取物导致的安全性风险小,在后续的浸出物研究试验中可不对该提取物进行研究;
✔ 对于高于 AET 的可提取物,需进行鉴别或结构确认以及半定量分析,进行初步毒理学评估以判断该物质是否对人体有害。
1、若该提取物对人体无特殊安全性风险,则在后续的浸出物研究试验中可不对该提取物进行研究;
2、若该提取物对人体有特殊的安全性风险或具有结构活性关系(SAR)的相关风险,则需在后续的迁移试验中进行该提取物的研究。
❏ 浸出物
✔ 如果浸出物含量低于人体每日允许暴露量(PDE)或 SCT 时,可认为浸出物的水平对人体产生的风险是可以接受的;
✔ 如果浸出物的含量高于 PDE ,则认为浸出物的水平所产生的风险是不可以接受的。如确定为包装系统中的部分组件引入,建议更换包装系统中该组件;
✔ 如果浸出物的含量高于 SCT ,需对化合物进行鉴定,并明确是否存在警示结构。如存在警示结构,建议进行该浸出物的细菌回复突变(Ames)试验;如其 Ames 试验结果为阳性,并确定为包装系统中的某个组件引入,建议更换包装系统中该组件;如不存在警示结构,则该浸出物的含量不得超过 QT 值,否则应进行毒理学评估。
[1] 《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》(国家药品监督管理局)
[2] 《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》(国家药品监督管理局)
[3] 《化学药品与弹性体密封件相容性研究技术指导原则(试行)》(国家药品监督管理局)
[4] 《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》
[5] USP<1663> Assessment of Extractables associated with Pharmaceutical Packaging/delivery System.
[6] USP<1664> Assessment of Drug Product Leachables associated with Pharmaceutical Packaging/delivery System.
[7] <660> CONTAINERS —GLASS
[8] <661> CONTAINERS —PLASTICS
[9] YBB00142002-2015《药品包装材料与药物相容性试验指导原则》
[10] 《ASTM F 1980:2002无菌医疗器械包装的加速老化试验标准指南》
[11] 残留溶剂指导原则 Q3C(R7)
[12] 元素杂质指导原则 Q3D(R1)
[13] M7评估和控制药物中 DNA 反应性(致突变)杂质以限制潜在的致癌风险行业指南
[14] 中国药典2020年四部指导原则 9101《药品质量标准分析方法验证指导原则》
[15] PQRI美国产品质量研究所-Product Quality Research Institute.
-END-
关于我们:
北京新领先医药科技发展有限公司分析测试中心拥有一千平米的专业实验室,配备药物分析领域的各种高端仪器设备40余台,主要包括电感耦合等离子体质谱仪(ICP-MS)、液质联用仪(LC-MS/MS)、气质联用仪(GC-MS/MS和GC-MS)、离子色谱仪(IC)、差示扫描量热仪(DSC)、红外光谱(IR)、高效液相色谱(HPLC,配备电喷雾检测器CAD)和气相色谱仪(GC)等。该中心不仅通过了ISO9001质量管理体系认证,并且即将获得CNAS认可资质。检测数据采集和处理系统均具备网络版审计追踪功能,可为广大客户提供安全、准确、可靠和可追溯的检测数据和结果。
该中心不仅研发技术团队高度专业化,检测技术和药物研发经验丰富,而且有非常强大的业界知名专家组成的顾问团队,以及与岛津和赛默飞仪器公司建立的联合实验室,可以使用世界上最先进的仪器设备,为药物研发企业提供专业、精准、快速的检测技术服务。
该中心的主要业务范围包括:符合国家药政法规的药物全生命周期质量研究、遗传毒性杂质检测、痕量残留物分析、元素杂质检测、药品接触系统相容性研究(药包材、生产组件和给药装置等)、抗生素类药物聚合物杂质研究、未知杂质结构解析、难获得杂质质谱研究,以及使用Derek和Sarah软件对含有遗传毒性警示结构的杂质进行毒性预测等多个检测技术领域。其中,聚合物杂质研究和难获得杂质质谱检测为业界首创技术,可为药物研发过程中的难点和痛点问题提供强有力的技术支持。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
