一文盘点:TCR-T细胞免疫治疗在肿瘤治疗中的研究进展
前言
过继性T细胞疗法是癌症免疫疗法的一个分支,旨在利用T细胞的特异性和功能来对抗肿瘤,主要包括:肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)、嵌合抗原受体T细胞(chimeric antigen receptor modified T cells,CAR-T)以及工程化T细胞受体修饰的T细胞(T-cell receptor-engineered T cells,TCR-T)等。
通过将能够特异性与抗原结合的TCR基因转入T淋巴细胞,使其获得与表达该抗原肿瘤细胞结合并诱发T细胞杀伤肿瘤细胞的能力。T细胞受体(TCRs)为T细胞提供识别信号,辅之以共刺激信号,该信号可以提供开/关信号来调节T细胞的激活。
T细胞受体是一种异二聚体,由两条不同的跨膜多肽链组成:一条α链和一条β链,每一条都包含一个固定区域,固定T细胞表面膜内的链,以及一个可变区域,识别并结合MHC呈递的抗原。额外的共刺激信号对T细胞功能的充分执行也是必不可少的,包括细胞毒性T细胞表面的CD8,它与I类MHC复合体结合,以及辅助性T细胞表面的CD4,它与II类MHC复合体结合[1]。
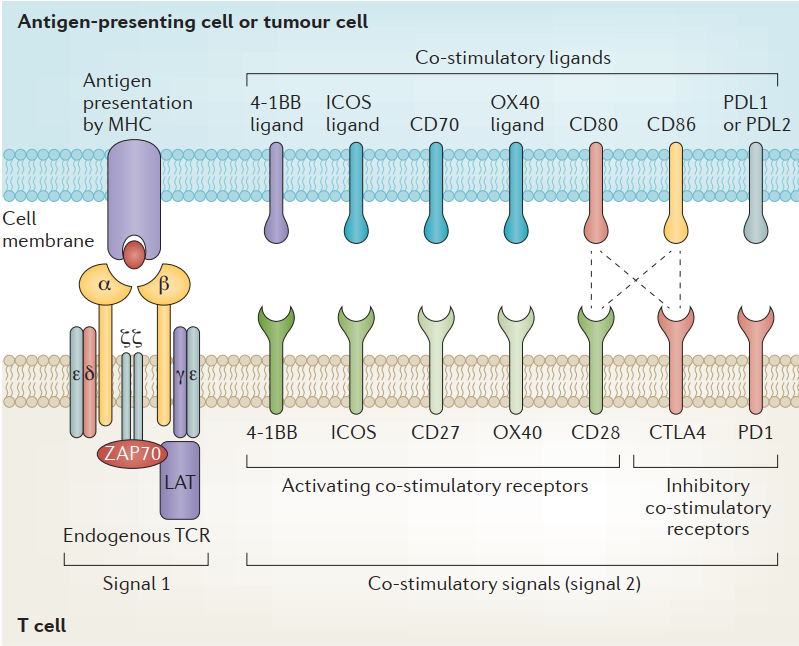
T细胞受体与T细胞的共刺激域 [2]
TCR-T与CAR-T作用机制的差异
目前,CAR-T在血液系统恶性肿瘤的临床治疗中效果显著。由于实体肿瘤的免疫抑制肿瘤微环境和肿瘤细胞表面的肿瘤相关抗原表达率较低(1 - 10%)等因素,限制了CAR-T在实体肿瘤的临床应用。
不同于CAR-T细胞只能识别细胞膜外的蛋白质,TCR-T细胞的主要优势是能够识别细胞外和细胞内的蛋白,而超过85%的细胞蛋白位于细胞内,所以对于实体瘤,TCR-T可以发挥更好的作用 [3]。
TCR的效力依赖于它与肽-主要组织相容性复合体(pMHC)的相互作用,pMHC即为肽结合于MHC形成的复合物。来自T细胞的TCR必须与患者的人类白细胞抗原(HLA)等位基因匹配,识别这些pMHC并杀伤癌细胞[1]。
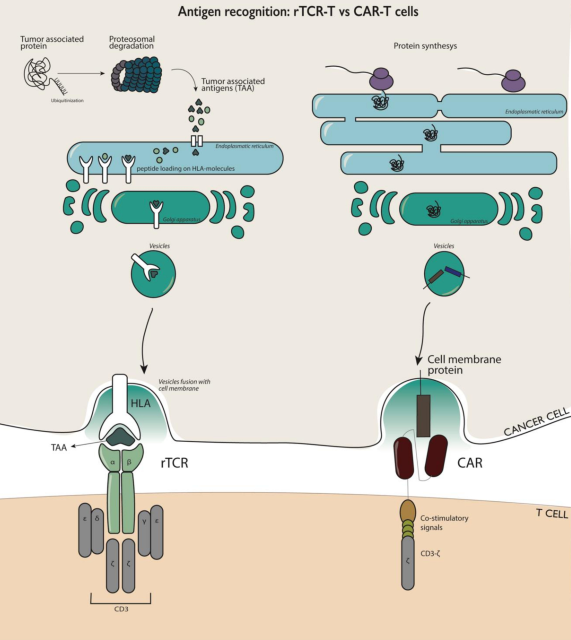
TCR-T细胞和CAR-T细胞的抗原识别和激活作用方式的差异

TCR-T细胞治疗的靶向抗原分布情况
TCR-T的临床研究现状
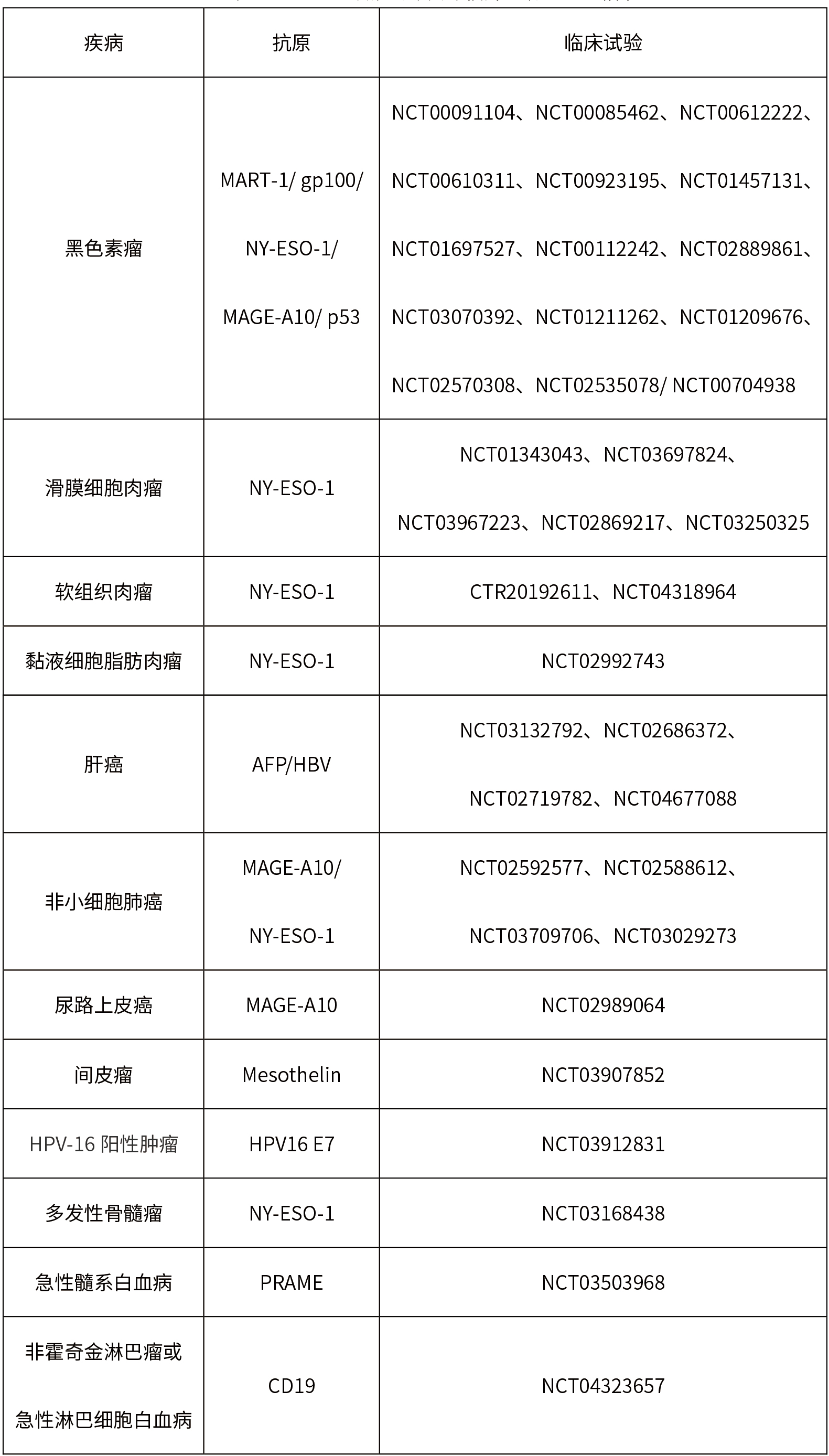
TCR-T细胞治疗的临床试验登记情况
黑素瘤是皮肤癌中恶性程度极高的一种肿瘤,一旦发生转移,即对术后辅助放化疗不敏感,预后极差。
2006年,首次对转移性黑色素瘤患者使用基因工程淋巴细胞表达黑色素细胞分化抗原特异性TCR (MART-1)的淋巴细胞治疗,临床反应率很低 (2/17) [5]。随后的一项识别MART-1抗原的TCR-T治疗的研究中,20例转移性黑色素瘤患者中有6例 (30%) 肿瘤消退 [6]。
此外,一项使用识别NY-ESO-1抗原的改良高亲和TCR的研究显示,6例滑膜细胞肉瘤患者中有4例 (60%) 有客观临床反应,11例黑色素瘤患者中有5例 (45%) 有客观临床反应 [7]。
滑膜细胞肉瘤是软组织肿瘤中极其罕见的恶性肿瘤,目前主要以手术治疗为主,具有局部侵袭性和转移率均高的特点,发生转移后患者预后较差。
ROBBINS等[8]将NY-ESO-1特异性的TCR基因转导入T细胞,用于治疗滑膜细胞肉瘤患者;Ⅰ期临床试验结果显示,病情PR率为66.7%(4/6),其中1例患者的PR时间持续18个月。4年后,ROBBINS等[9]再次将针对NY-ESO-1的TCR-T细胞用于治疗滑膜细胞肉瘤患者,Ⅱ期临床试验结果显示病情反应率为61%(11/18);其中,10例患者达到PR,1例患者达到CR且时间超过20个月;随访发现3年和5年生存率分别为38%和14%。
此外,一项12例转移性滑膜肉瘤患者自体输注识别NY-ESO-1抗原的TCR-T细胞临床试验,50%的患者 (6/12) 出现了经证实的抗肿瘤反应,肿瘤在几个月内有不同程度的缩小[10]。
在其他肿瘤如肝癌、肺癌、间皮瘤、尿路上皮癌、食管癌、多发性骨髓瘤等肿瘤治疗中,TCR-T细胞免疫治疗也正在用于临床研究。
KAGEYAMA等[11]将MAGE-A4作为靶抗原的TCR基因转导入T细胞,用于治疗10例食管癌患者,其中3例患者存活时间超过27个月,7例患者在治疗2个月内发生疾病进展。
一项采用识别NY-ESO-1/ LAGE-1抗原的TCR-T治疗20例多发性骨髓瘤患者,20例晚期患者中有16例 (80%) 观察到临床反应,中位无进展生存期为19.1个月[12]。
展望
到目前为止,TCR-T细胞免疫疗法已在部分实体肿瘤的治疗中取得了较好的疗效,特别是对黑素瘤、滑膜细胞肉瘤的治疗效果很明显。TCR-T细胞免疫疗法作为当前过继性T细胞治疗中最新的技术之一,能够通过表达特异性受体T细胞而靶向识别特异性的肿瘤细胞。
随着相关技术的发展和研究的不断深入,TCR-T细胞免疫疗法将逐渐向高效、低毒及可操控的通用型方向发展,从而在肿瘤治疗中具有更加理想的应用前景。
参考文献:
[1] Jianxiang Zhang, Lingyu Wang. The Emerging World of TCR-T Cell Trials Against Cancer: A Systematic Review. doi: 10.1177/1533033819831068.
[2] Andrew D. Fesnak, Carl H. June and Bruce L. Levine. Engineered T cells: the promise and challenges of cancer immunotherapy. doi:10.1038/nrc.2016.97.
[3] Vania Lo Presti, Frank Buitenwerf, Niek P. van Til, et al. Gene Augmentation and Editing to Improve TCR Engineered T Cell Therapy against Solid Tumors.[J]. Vaccines 2020, 8, 733.
[4] Liu Q , Cai W , Zhang W , et al. Cancer immunotherapy using T-cell receptor engineered T cell[J]. Ann Blood 2020;5:5.
[5] Morgan, R. A., Dudley, M. E., Wunderlich, J. R. et al. 2006 Cancer regression in patients after transfer of genetically engineered lymphocytes[J]. Science 314:126-129.
[6] Johnson L A , Morgan R A , Dudley M E , et al. Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen[J]. Blood, 2009, 114(3):535-546.
[7] Robbins P. F., Morgan R. A., Feldman S. A. et al. 2011 Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J. Clin. Oncol. 29:917-924.
[8] ROBBINS PF, MORGAN RA, FELDMAN SA, et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1[J]. J Clin Oncol, 2011, 29(7): 917-924.
[9] ROBBINS PF, KASSIM SH, TRAN TL, et al. A pilot trial using lymphocytes genetically engineered with an NYESO-1-reactive T-cell receptor:longterm follow-up and correlates with response[J]. Clin Cancer Res, 2015, 21(5): 1019-1027.
[10] D'Angelo S P , Luca M , Merchant M S , et al. Antitumor Activity Associated with Prolonged Persistence of Adoptively Transferred NY-ESO-1c259T Cells in Synovial Sarcoma[J]. Cancer Discovery, 2018:CD-17-1417.
[11] KAGEYAMA S, IKEDA H, MIYAHARA Y, et al. Adoptive transfer of MAGE-A4 T-cell receptor gene-transduced lymphocytes in patients with recurrent esophageal cancer[J]. Clin Cancer Res, 2015, 21(10): 2268-2277.
[12] Rapoport A P , EA Stadtmauer, Binder-Scholl G K , et al. NY-ESO-1–specific TCR–engineered T cells mediate sustained antigen-specific antitumor effects in myeloma[J]. Nat Med. 2015 August ; 21(8): 914–921.
-END-
关于我们:
郑州深蓝海生物医药是北京新领先在临床CRO领域打造的一个知名品牌。公司拥有300余人高专业水准的临床服务团队,并在石家庄、武汉、长沙、杭州、郑州、沈阳、贵州、大连、广州、西安等20多个中心城市设立驻地办事处。
公司下设医学部、临床运营部、数据部、质量控制委员会、药物警戒部、注册部和人类遗传资源管理委员会等部门。能够通过创新的服务模式和多维的信息化技术,推动临床研究的发展及临床研究外包服务模式的变革,为客户提供多元化的研发支持和服务,包括创新药和仿制药的Ⅰ~Ⅳ期临床试验、仿制药生物等效性(BE)试验及药代动力学(PK/PD)临床研究、体内外相关性研究(IVIVR)、医疗器械临床研究及第三方稽查等,全面覆盖大小分子药物,满足不同类型企业的临床研究需求,为国内外客户打通新药上市前最关键的瓶颈。
目前,公司已经与国内近1000家药物临床机构、600余家临床医院建立合作,如北京大学第一医院、北京安贞医院、北京阜外心血管医院、上海长海医院、复旦大学附属中山医院、江苏省人民医院、吉林大学中日联谊医院、哈尔滨医科大学附属第一医院、广东中医院、天津中医药大学附属第一医院等,合作医院科室1500余个。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
