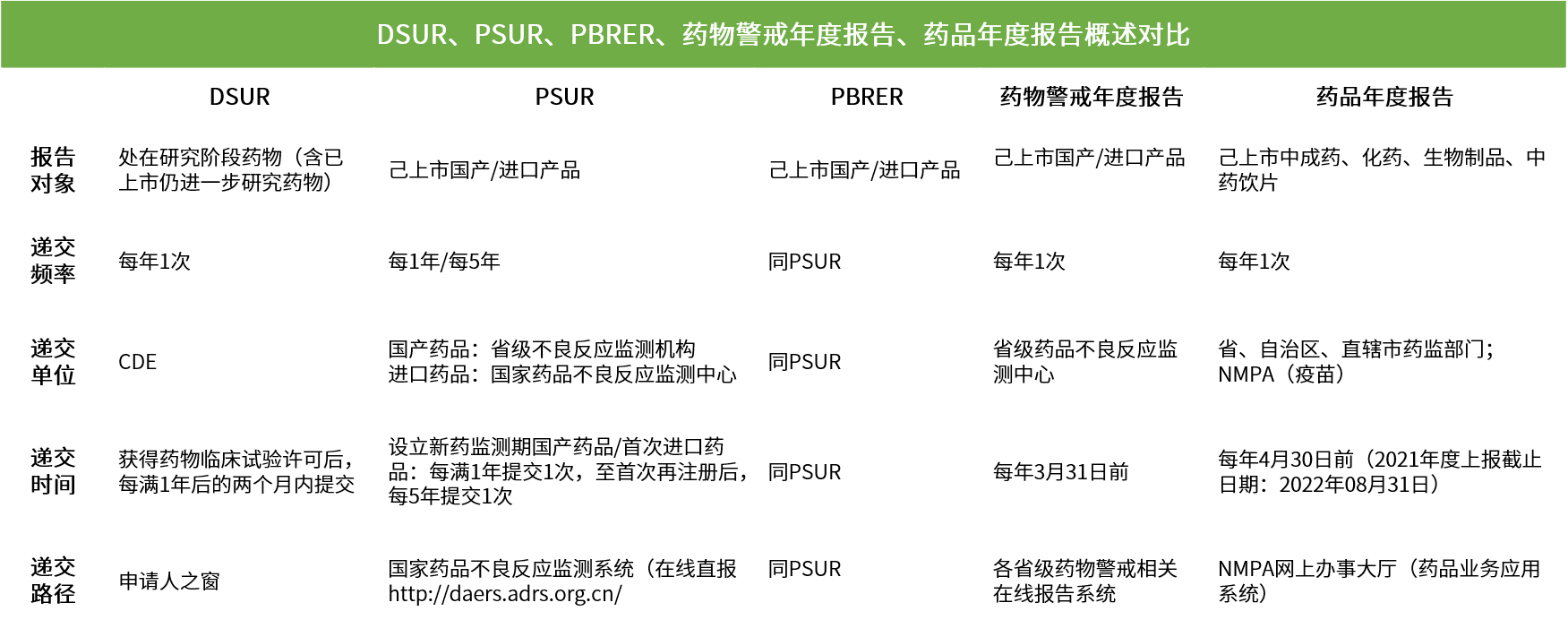
汇总 | 临床及上市后药物安全性报告要求(附报告概述对比图)
临床试验期间
临床试验期间的报告主要分为两类,研发期间安全性更新报告(DSUR)和药物临床试验期间安全性数据快速报告。其中,药物临床试验期间安全性数据快速报告主要包括非预期且严重的不良反应的快速报告(SUSAR快速报告)、及其他潜在严重安全性风险信息快速报告。
DSUR:
申办者应当定期在药品审评中心网站提交DSUR。DSUR应当每年提交一次,于药物临床试验获准后每满一年后的两个月内提交。药品审评中心可以根据审查情况,要求申办者调整报告周期。
-
DSUR的准备、撰写与提交,参照“ICH-E2F”及《研发期间安全性更新报告管理规范(试行)》。
-
国家药品监督管理局药品审评中心通告2020年第7号,要求《化学药IND申请药学研究年度报告(试行)》与研发期间安全性更新报告统一,不再单独提交。
自2018年5月1日起,药物临床研究期间报告SUSAR适用《E2A:临床安全数据的管理:快速报告的定义和标准》和《E2B(R3):临床安全数据的管理:个例安全报告传输的数据元素》。2018年5月1日后开始实施的临床试验,按照《药物临床试验期间安全性数据快速报告的标准和程序》执行。
SUSAR快速报告提交途径:
-
GATEWAY方式提交:申请人申请GATEWAY账号并进行电子传输测试,测试成功后,正式提交。
-
XML文件方式提交:申请人登陆国家药品审评中心网站,在“申请人之窗”注册账号,在左侧菜单栏下的“药物警戒提交”提交XML格式文件。
其他潜在的严重安全性风险信息包括:明显影响药品风险/获益评估的信息;可能导致药品用法用量改变;影响药品总体研发进展。如:新近完成的动物实验中的重大安全性发现。
提交途径:
-
方式一:申请人之窗“研发期间安全性相关报告递交”;
-
方式二:发送电子邮件至:lcqjywjj@cde.org.cn。
药品上市后报告
药品上市后报告主要分为四类,定期安全性更新报告(PSUR)、定期获益-风险评估报告(PBRER)、药物警戒年度报告和药品年度报告。

PSUR的主要目的是全面了解经批准的药品的安全性。
PBRER的主要目的是对药品风险和批准适应症的获益中新的或新出现的信息进行全面、简明和重点分析。
ICH观点:鉴于对一个药品的获益考虑进行风险评估是最有意义的,特别是当风险估计发生重要变化时,PBRER将比PSUR更为重视获益。PBRER、药物开发安全性更新报告(DSUR,ICH E2F)和风险管理计划(ICH E2E)中的安全性规范的相应章节内容可以相同。
2019年11月29日,国家药品不良反应监测中心组织并发布《药品上市许可持有人药物警戒年度报告撰写指南(试行)》。旨在规范持有人撰写药物警戒年度报告,总结药物警戒体系建设、药品风险评估和控制等,落实持有人全生命周期主体责任。
药物警戒年度报告主要分为10部分,包括持有人信息、药品信息、药物警戒体系、各例药品不良反应报告、定期分析评估、风险评估和控制、上市后安全性研究、药物警戒工作自评、其他说明及附件列表。
2022年4月12日,国家药监局组织制定《药品年度报告管理规定》(国药监药管[2022]16号),同时,为保障药品年度报告制度的落地实施,国家药监局建设了药品年度报告采集模块,同期启用。

-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
