临研必读 | 临床试验现场核查相关流程及核查问题汇总
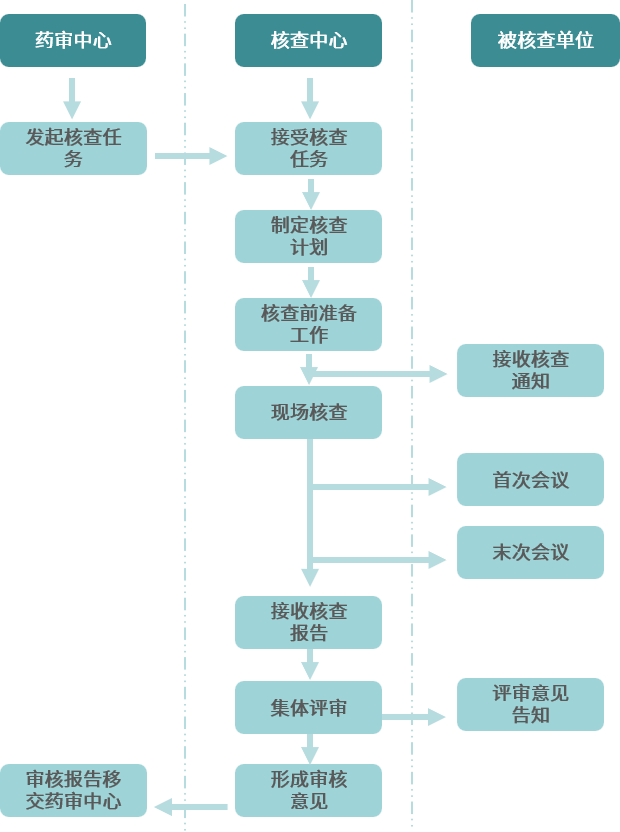
药物临床试验现场核查工作流程
现场核查准备
申办者首先应预估现场核查时间(平均核查7天,平均核查研究中心3-4个,根据项目情况(抽样的风险因素,新中心、数据明现异常、安全性报告多等因素)制定),通知可能被核查单位、伦理、研究者等相关人员,再次梳理和熟悉临床研究相关资料,查阅医院HIS系统,准备PPT汇报。
研究中心接到通知,立即通知PI和主要参与人员,通知院领导、机构、伦理相关人员,通知相关委托方和协作方,PI/主要参与人员再次梳理和熟悉临床研究相关资料,审阅PPT,熟悉潜在的问题及其回复,与相关科室协调,准备各项原始资料溯源,准备核查会议室及办公用品。
-
再次审阅研究中心既往自查整改中的重要关键问题,讨论并确定回答策略
-
相关研究者(含研究护士)、CRC以及指定的CRA务必提前熟悉相关问题和记录文件
-
各流程负责人员,如知情同意签署流程、药物管理流程、生物样本管理流程、每次访视流程、溯源流程等,相关人员务必熟悉操作细节
-
根据GCP/项目/中心要求妥善保存好文件(研究者文件夹、受试者文件夹、原始病历)
-
提前准备好核查组要求提供的文件(首次会议PPT+日程表、方案摘要、研究者分工授权表、鉴认代码表、筛选入选表、PD列表、伦理文件夹)
-
其他文件:如问题说明文件、需要备份的信息文件(EDC数据备份等,备用,不主动提供)
-
HIS/LIS 溯源系统、影像科(OCT\FA\FP)溯源系统
-
溯源位置、溯源电脑、溯源账号、溯源权限、参与溯源的研究人员/信息科人员、是否提前预约
现场核查过程
在核查过程中,熟悉临床研究过程和资料的人员需全程陪同协助核查,对专家提出的问题及时沟通并反馈,监查员、申办方相关人员需全程参加,主要研究者(PI)需在重要节点积极参与,包括核查首次会议、期间沟通讨论会、总结会等。
以下汇总了部分主要核查问题:
涉及入排标准违背;受试者的检查结果尚未全部出来就给受试者用药;用药未严格按照方案进行;受试者部分检查时间超窗或遗漏;试验过程中漏做某项检查等。
受试者在其他医院或科室就诊开具非试验药物,或受试者发生了不良事件(AE)而开具非试验用药;受试者帮助其亲属开具药物,本人并未使用;合并用药的漏记常伴随着AE漏报。
筛选日期早于知情同意的日期 (预筛选);受试者鉴认代码表中信息不全(缺少受试者的身份证信息等);受试者未提供身份证复印件;知情同意书受试者与研究者签字日期不一致。
药物运输、保存时无温度记录;药物配送数量与使用、回收不一致;药物存储温度无记录人签字;用药记录与受试者日记卡不一致;无受试者用药日记卡;GCP处方上无核对者签名或发药人与核对者不一致。
受试者的检查报告上缺少研究者的签名和判断;检查时间先于知情同意时间;受试者部分检查时间超窗或遗漏;妊娠检查结果无法溯源(建议抽血检查,若进行尿妊娠试验,要有照片及相应的记录)。
参考法规:
国家食品药品监督管理总局关于发布药物临床试验数据现场核查要点的公告(2015年第228号)
国家食品药品监督管理总局药物临床试验数据核查工作程序(暂行)
-END-



转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
