建议收藏!原料药合成中起始原料杂质控制策略!
起始原料(Starting material)是构成API 结构的重要结构组成部分的一种原料、中间体或API。它可以是已上市的商品、以合同或商业协议方式购自一家或多家供应商的产品,或是企业自己生产的物质。根据国内外GMP要求,起始原料作为GMP监控的起点,需要接受国内外官方机构的监督检查。
依据ICH Q11起始原料选择依据,起始原料的选择依据以下几条:
1)原料A和B为原料药API构成具有疗效的关键结构片段。
2)原料A和B/中间体C/D质量标准均已建立,相关杂质(有机杂质,致突变杂质,残留溶剂和元素杂质)控制,确保上述杂质经过后续生产工艺可以有效去除,残留符合相关ICH指导原则限度。
3)原料药API中相关药典规定的杂质在制备中间体C和中间体D中产生并且进行控制,确保生产的原料药符合内控标准要求。
4)原料药申报路线与原研厂家路线一致,或甚至更长(若适用)。
5)对于外购物料A和B,进行供应商审计和资质确认,签订质量协议,要求对原料质量可能产生影响的任何变更及时通知药品企业。
我们根据供应商提供的起始原料的合成工艺,对其中可能存在的有机杂质进行了理论分析。可能存在的有机杂质有:

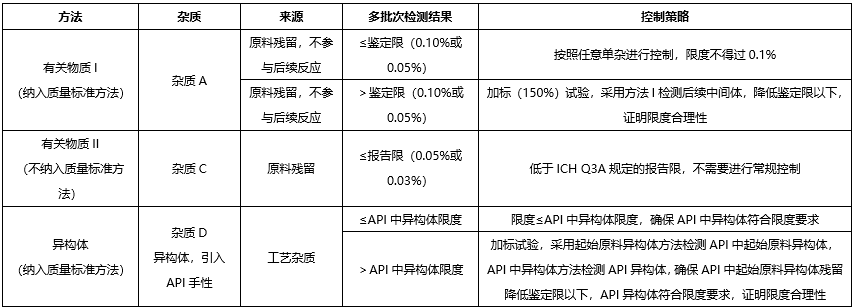
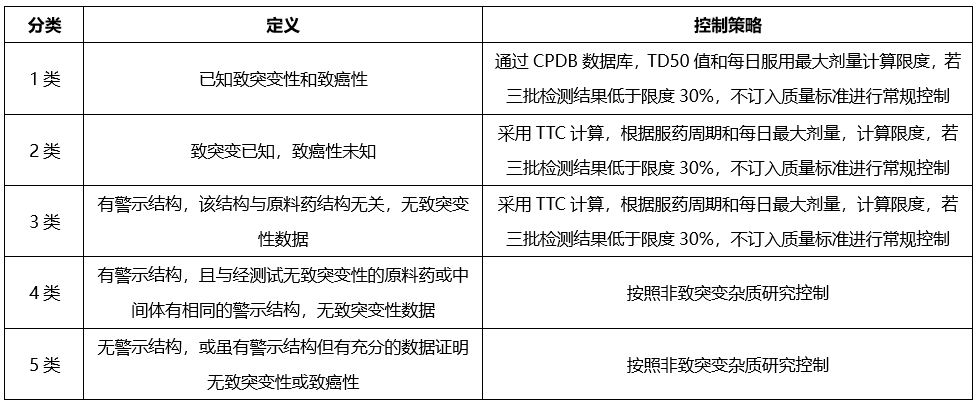
已确定的某些结构基团具有较高的致癌性,即使摄入量低于TTC水平,理论上仍会具有高致癌风险,这类高效致癌性致突变致癌物,被称为关注队列,其中包括黄曲霉毒素类,N-亚硝基化合物,烷基-氧化偶氮基化合物。
我们开发致突变杂质相关方法检测上述致突变杂质,杂质控制策略如下:

根据起始原料合成工艺、终产品合成工艺,ICH Q3C,确定控制策略如下:
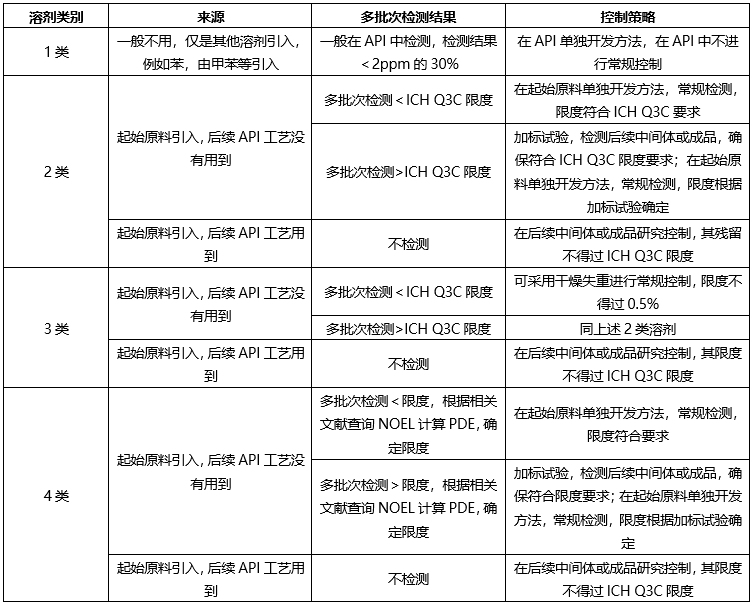
❖起始原料控制策略-无机杂质(元素杂质)
根据起始原料合成工艺,如果仅使用钠盐,钾盐,采用炽灼残渣进行控制;如果使用特殊元素杂质,需要根据ICH Q3D进行元素杂质控制。
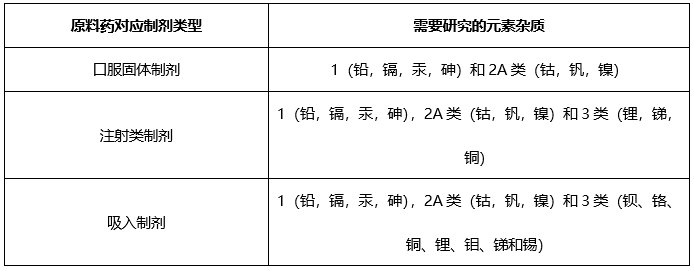
元素杂质(仅针对口服固体原料药)
根据起始原料合成工艺、终产品合成工艺,根据ICH Q3D,确定控制策略:
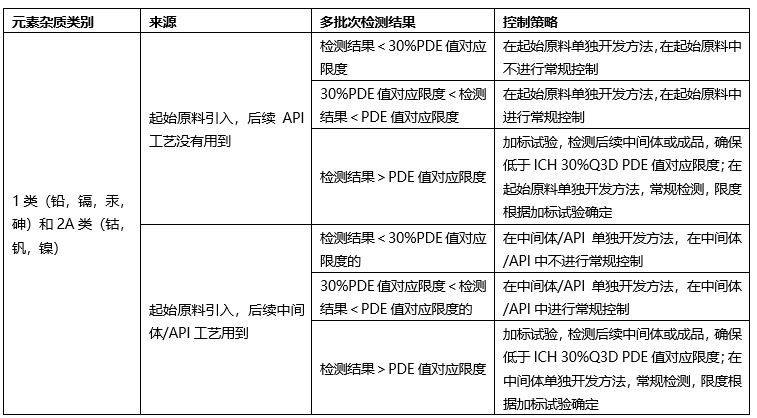
❖起始原料的质量标准
至少包含外观,鉴别,比旋度(若有手性),有关物质(特定杂质,任意单杂和总杂),致突变杂质(若有),残留溶剂(二类溶剂,若有),干燥失重(控制三类溶剂,若有),炽灼残渣(无机杂质控制)和含量。
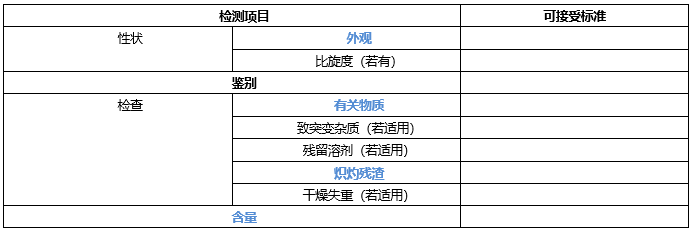
*蓝色字体,标准中必须包含项目,黑色字体根据实际检测结构确定是否增订入质量标准
根据国内法规,要求对起始原料进行供应商审计,提交审计报告。
起始物料供应商审计目的,可以帮助药品生产企业确认以下内容,降低注册风险:
★ 确定供应商提供合成路线是真实的,完整的,质量研究工作没有遗漏。
★ 现场查看供应商生产情况和质量情况,关注持续供货能力。
★ 现场签订质量协议,明确说明,如果工艺变更,需要提前通知。
★ 现场获得相关ISO/GMP证书(若有),相关TSE/BSE声明,OVI声明(残留溶剂声明),元素杂质声明等。
ICH Q7 活性药物成分(API)的GMP指南
ICH Q3A 新原料药中杂质
ICH Q3C 残留溶剂的指导原则
ICH Q3D 元素杂质指导原则
ICH Q11 原料药开发和生产
80号文化学药品新注册分类申报资料要求
-END-
关于我们:
原料药研究事业部现有研发人员近百人,近80%为硕士或博士学历。由具有10年以上国内外项目管理、药品开发、生产转化、注册申报经验人员作为主要研究和管理者,形成具有集产品立项、高端中间体、工艺开发、质量全面研究、产业化转移、中美双报、单制剂原料药评价于一体的原料药全产业链构架。
事业部由6大中心组成,分别是工艺研发中心、产业化中心、质控中心、杂质中心、注册中心和技术服务中心。工艺研发中心主要包含抗生素研发平台、创新工艺研发平台、复杂药物分析研发平台、结晶研发平台和原料药粉体学研究平台。产业化中心主要包含起始原料、API资质控制平台、工艺验证、技术转移风险控制平台。质控中心主要包含方法学建立和验证平台、杂质研究技术包服务平台。杂质中心主要包括杂质制备、MS检测和公共对照品控制等。注册中心注册经验丰富,可以承接中美双报。技术服务中心服务于立项、市场、制剂、采购部等与原料相关的技术支持。
新领先医药原料药事业部可以助力广大业内中间体生产商实现产业升级为原料药供应商、助力制药企业快速确定起始原料供应商、快速完成研发、转移、注册申报,获得生产批件。
转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
