收藏!缓释微球制剂的质量控制
所谓药物缓释,是指使药物在生物体内缓慢释放或控制药物以一定速度释放,以达到其在特定部位释放或按预设速度释放的目的。例如现在研究较为广泛的载药微囊缓释系统以及载药微球缓释系统等,均具有药物缓释体系的典型优良特性。
微球(microsphere)是指药物分散于或被吸附在聚合物基质、高分子中而形成的一种微粒分散体系。微球作为一种应用较为普遍的新型给药系统,其粒径一般分布在 1~250µm 的范围内,粒径在10~1000nm 之间的称纳米球。该技术开发的制剂可用于肌肉注射、动静脉注射、粘膜给药、关节腔内给药、口服以及皮内注射等几乎各种方式的给药途径。
国外对载药微球的研究开始较早并正在逐步深入,20 世纪八九十年代,一些研究机构如美国佛罗里达大学、法国巴黎第十一大学、日本秋田大学和日本城西大学等都设立有专门的载药微球研究室,近些年来,也有成型的载药微球商品(如淀粉微球)出售。我国对载药微球的研究开始时间相对较晚,虽然已取得了一些初步成果,但技术还不成熟,上市药品较少。
相比于传统的剂型,微球制剂的主要优点在于:
➺掩盖药物的不良气味及口味;
➺提高药物的稳定性,防止药物在体内失活;
➺通过载体材料及制备技术的选择,可实现药物在体内的缓慢持续释放,减轻患者频繁多次给药的痛苦,提高患者顺应性;
➺可使药物浓集于靶区,提高疗效,减少药物的毒副作用;
➺除药物外,还可将活细胞包埋于载体内。
缓释微球制剂在临床上的释药周期往往长达数周,甚至数月,一旦不能保证产品的质量(如突释过高,释放周期难以控制,载体材料的安全性等方面),会导致发生毒副作用甚至威胁患者的生命,所以对于微球制剂应该具有比常规制剂更加严格的质量要求和批次间的重复性要求。
我们结合各指导原则及研发经验,确定以下方面需要关注:目前,各国药典采取指导原则的形式对微球制剂的质量评价提出了要求和规定,如微球指导原则首次出现在15版药典中,并在2020版进行提升,提出了“微粒制剂指导原则”,对国内进行缓释微球开发的药企提出了质量控制的导向。
通过扫描电子显微镜(SEM)或者透射电子显微镜(TEM)观察微球的形态,如形状(圆形或类圆形)、表面形貌(光滑或粗糙)、骨架结构(多孔或实心)(图1)。理想微球的微观形态应为圆整球型或椭圆形实体,形态饱满,颗粒的大小应尽可能均匀,微球之间无粘连。微球形态与结构的不同对微球的载药量以及释放行为有显著影响。表面粗糙的微球易吸附药物结晶,往往会导致高突释。通过对微球形态进行观测,总结形态与处方工艺之间的关系,不但可以对微球的制备机理进行探索,还可以对释放行为进行优化。

图1 电镜下不同形态的微球
SEM是目前观察微球形态使用最广泛的方法,被用于表面及切面形态的观察(见图2)。TEM 分辨率高,图像为二级结构平面,适用于亚微球、纳米球粒径测定。此外还有原子力学显微镜(atomic force microscopy,AFM)可用于观察微球形态,AFM 优点之一是分辨率高,与 SEM 相比,不需要对样品进行金属喷镀,避免了喷镀后对样品的表面形态造成的破坏,并且AFM 允许在液态环境下观测样品,而 SEM 则不行。但是 AFM 缺点是观察范围窄,得到数据不具有统计性,适合单个粒子表面形态的观察。

图2 SEM 观察的 PLGA-Glu 微球图像
(A)全视图 (B)单个微球表面图 (C)单个微球切面图
粒径及粒径分布是影响微球制剂释放行为的关键因素,其对缓释微球的包封率、释放行为模式、降解速率都有一定影响,因此粒径大小及分布是质量控制中一个很重要的指标。随着检测手段的进步,粒径大小及其分布测定由传统的光学显微镜视野测定发展到电子显微镜的逐一统计再发展到近年来应用广泛的激光粒度仪绘制粒径大小分布图,可以在制备过程中的每一步工艺里对粒径大小及分布进行追踪检测进而得到目标微球,表1介绍了各种方法的特点。
表1 常用微球的粒度及粒度分布检测方法
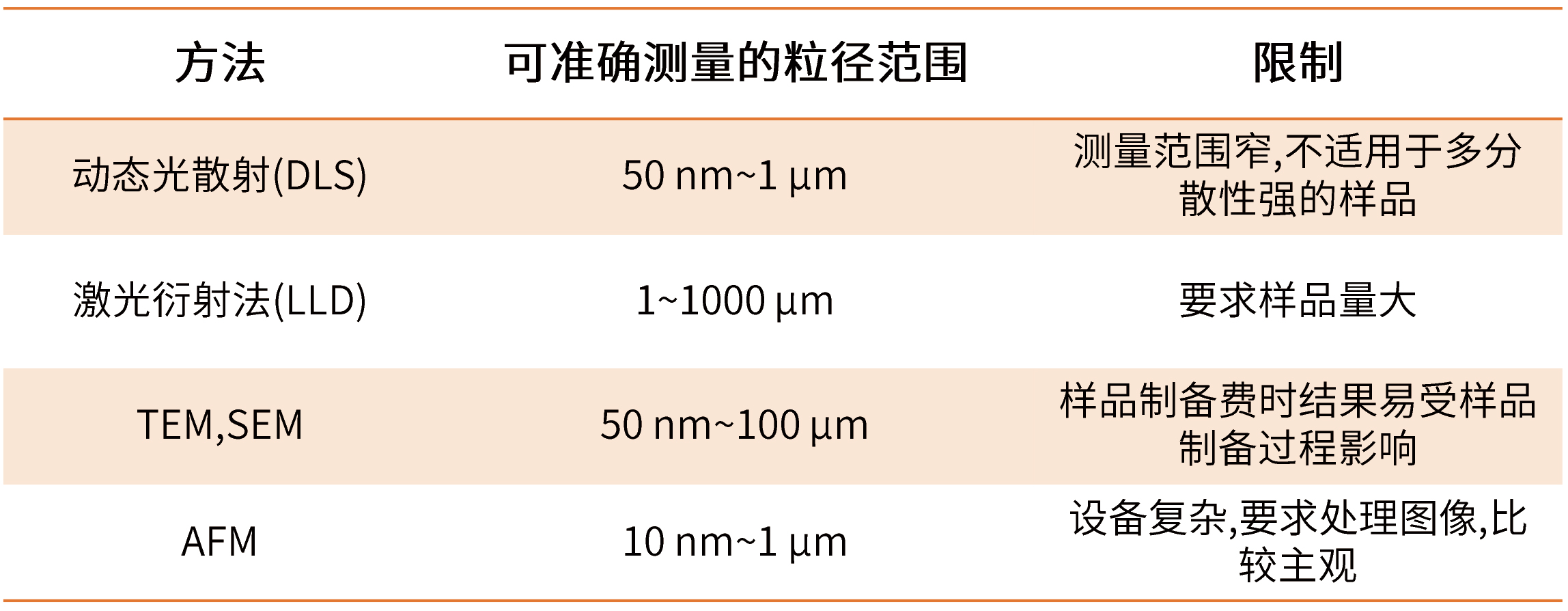
而 粒 径 的 分 布 除 了 可 用 粒 径 分 布 图 表 示 , 还 可 用 多 分 散 性 指 数(polydispersity index,PDI)和跨距表示。跨距与多分散性指数数值越小,表示粒径分布越均匀。
由于微球制剂与普通制剂不一样,除了必要的辅料,在生产过程中还可能会使用二氯甲烷、正庚烷、乙醇或乙酸乙酯等有机溶剂,制备过程中引入的油相(有机溶剂)在固化的过程中会存在未能完全除去的问题,诸如丙酮、乙酸乙酯、二氯甲烷等的残留不仅影响微球储存的稳定性,还会在注射后引起人体的副作用,因此每个国家的药典都对微球的有机溶剂残留量有着严格的要求。依据 ICH 指导原则分类,二氯甲烷属于第二类残留溶剂,而正庚烷、乙醇和乙酸乙酯为第三类残留溶剂,因此必须对其限度进行控制。
此外,对于固体无菌粉末制剂,一般都要求控制水分的含量。由于微球制剂大都是多肽或蛋白类药物,这类药物对热不稳定,因此不适合采用干燥失重的方法测定水分,可以采用卡尔-费休氏水分测定方法来完成。
载药量和包封率是反映微球制剂中药物含量的重要指标,载药量的批间稳定性也是工艺成熟的重要标志。
载药量是指微球制剂中所含药物的质量分数,其检测方法一般是先采用合适的有机溶剂将微球高分子材料骨架溶解,再根据药物的性质选择不同的方法将药物分离或提取出来,进行含量测定。
包封率是指微球制剂中包封的药量占微球制剂中包封与未包封总药量的比值,其测定先要将微球粉末溶于注射用溶剂,再通过离心法、过滤法、凝胶柱色谱法分离后测定。
二者是衡量制备工艺和成本的重要指标。载药量和包封率的计算都需要建立在药物含量测定的基础上,目前上市的微球制剂所用载体多为聚乳酸-羟基乙酸共聚物(PLGA)。由于 PLGA 易溶于二氯甲烷、三氯甲烷、二甲亚砜等有机溶剂,而不溶于水、醇。依据药物和 PLGA 的溶解性质,PLGA 微球常用的含量测定方法有:
① 先用有机溶剂溶解 PLGA 和药物,再用不溶于 PLGA 溶剂沉淀 PLGA,经过离心或过滤后,取上清进液相测定含量;
② 先用有机溶剂溶解 PLGA 和药物,再加入醋酸盐缓冲液等溶剂提取多肽后进样分析;
③ 溶剂溶解 PLGA 及药物后,直接进样测定。
方法比较:
方法①和②需要在测定之前将高聚物与药物分离,而且分离过程使用的试剂容易导致药物损失。方法③的优势在于无需将高聚物与药物分离,但是应用较少,需要使用质谱等特殊仪器。
释放行为是根据临床适应症需求和高分子聚合物材料性质共同决定的。选择合适的高分子聚合物材料与工艺制备不同结构的载药微球,使活性成分按照预期的药代动力学模型释放。
-
释放速率
对于可生物降解材料,溶胀和溶蚀机制也是控制药物释放的主要因素。释放介质的组成、pH 值、离子强度、渗透压和温度等都会对释放速率产生影响。
在载药微球的研发阶段,应确定好合适的体外释放条件,并根据体内释放条件建立体内、体外相关性。对于释放周期较长的载药微球,可以建立加快释放试验的方法,预测模拟常规释放行为。建立加速释放的条件要遵循相关性原则,使加速释放曲线尽量拟合常规释放曲线,得到准确的相关性。
-
突释效应
同时需要注意的是载药微球的突释效应,在微球释放的最初阶段,吸附在微球表面的药物会通过扩散作用而快速释放,称为突释效应。由于微球表面吸附的药物大量释放,短时间内使局部药物浓度快速升高,极易引起副作用。
突释效应可能导致人体内药物浓度在短时间内迅速升高,并使得药物效期缩短,是限制微球广泛应用的关键问题,因此在质量控制过程中必须重点关注突释率这一指标。
2020 版《中国药典》明确规定载药微球在前 0.5h 内释放的药物含量要低于40%,收载的释放度测定法包括桨法、篮法、杯法,用以上方法测定释放度不仅需要大量的样品,而且释放后测得的药物浓度偏低,已无法满足检验要求。而对于缓释微球制剂的体外释放方法,目前并没有统一的标准要求,目前报道的微球制剂体外释放度测定方法主要有:
① 直接释药法,这是目前最常用的方法,包括摇床法和恒温水浴静态法。微球制剂置含有介质的容器中保持恒温封闭,一定时间取样并补充新鲜介质。
② 流通池法,系统由恒流泵、温控流通池、存储瓶、过滤系统、取样系统和样品收集系统组成。此法已被美国药典收载,被广泛应用于缓释制剂的研究。
③ 透析膜扩散法,该法是指将微球放入透析管中,并将其放入介质中测定。3种方法优缺点比较见表2。
表2 微球制剂体外释放度实验方法的比较

除了改进体外释放度的实验装置,还可以通过调节释放介质温度、pH 值、离子强度、搅拌速率以及使用表面活性剂、酶等方式能实现微球体外加速释放,而达到缩短检验周期,提高检验效率的目的。
鉴于已上市的产品大部分为多肽微球,其相关杂质包括降解杂质、工艺杂质以及聚合物杂质:
➺ 降解杂质包括药物在生产、储存过程中发生水解、氧化反应而生成的产物。
➺ 工艺杂质中得到最广泛关注的是乙酰化杂质,这类杂质是由药物多肽中的氨基、羟基与 PLGA 的羧基末端经过化学反应生成的,这种杂质目前在 PLGA 微球中广泛存在。乙酰化杂质的产生与多肽自身结构有关,质谱和毛细管电泳技术联合使用可用于其他多肽微球的乙酰化杂质检测。
➺ 聚合物杂质包括多肽或蛋白自身相聚合形成的杂质,以及聚合物-多肽杂质。
缓释微球的微生物检查比一般冻干制剂要求更加严格,这是因为在微球的制备和生产过程中,众多环节很有可能引入微生物,而微球的尺寸以及高分子材料的特性使微生物更易吸附在其表面,也可以被包裹在骨架内部,所以要在微球的内部以及外部根据不同的制备条件对内毒素和无菌作系统全面的筛查。微球制剂的细菌内毒素和无菌检查,需要进行球内和球外部检测实验。
目前,针对已上市的微球,可以利用一定浓度的二甲基亚砜将微球溶解和破碎,将溶解后全部液体接种至培养基中,运用显微镜观察溶解和培养过程。
Zeta电位也是微球的一个重要属性,Zeta电位往往能指征微球制剂的稳定性,而这一指标却容易被忽视。在微粒分散体系的溶液中,其表面带有同种离子,通过静电引力吸附和扩散作用,在微粒周围形成的吸附层与相邻的扩散层共同构成微粒的双电层结构,从吸附层表面至反离子电荷为零处的电位差叫动电位,即Zeta电位。Zeta电位值可以反映微粒的物理稳定性,Zeta电位越大,微粒之间的排斥作用越强,絮凝或沉积的可能性越小,微粒在溶液中越稳定。一般ζ电位绝对值大于15mV,可以达到稳定性要求。
目前市场上测量Zeta电位已有专门的Zeta电位仪,英国马尔文和美国贝克曼公司都已推出电位仪系列产品,直接进样就可以读出Zeta电位值。
微球制剂的缓释功能是通过载体辅料实现的,这些载体辅料通常无毒、可降解并具有良好生物相容性。常用的微球制剂载体辅料包括天然材料(如明胶、壳聚糖、淀粉、白蛋白),半合成材料(多为纤维素衍生物)以及合成材料(聚乳酸、聚氨基酸、聚羟基丁酸酯、聚乳酸-羟基乙酸共聚物等)。此外,在微球生产过程还需要加入乳化剂、润湿剂以及表面活性剂等辅料。载体辅料的分子量及分布范围、组成单体的比例、以及玻璃转化温度(glass transition temperature,Tg)都会影响微球的释放周期、释放速度。
分子量及其分布测定主要采用凝胶渗透色谱法(GPC),并以重均分子量(Mw)、数均分子量(Mn)和分子量分散系数(Mw/Mn),或者绘制分子量分布曲线来表征其分子量。
在微球药物的释放过程中,药物的释放伴随着聚合物骨架的水解。聚合物降解的速率决定药物释放的速率。因此可以在释放过程中观察微球的形态,并通过凝胶渗透色谱法(GPC)检测不同时刻高分子聚合物载体的分子量,通过形态及分子量的变化监控微球降解释放过程。这些信息对于筛选骨架材料、优化制备工艺有着重要意义。
玻璃转化温度(Tg)是载体辅料在玻璃态和高弹态之间相互转化的温度,在一定程度上可以反映微球的稳定性。Tg 可以通过差示扫描量热分析法进行测定。在质量控制过程中,关注载体辅料分子量等特性变化,可以帮助我们理解微球降解机理,优化处方工艺。
在高分子聚合物材料析出形成微球后,聚合物的Tg会发生改变。因为当聚合物和药物或溶剂共同存在时,易产生共价键吸引力,使得聚合物的Tg降低。比较常用的 Tg 检测方法是差示热分析法(DTA)和差示扫描量热法(DSC)。高分子聚合物的晶型与结晶度的变化可以从侧面反映药物的释放速率和微球的降解速度。可利用X射线衍射法检测聚合物结晶度从而佐证载药微球的释放行为与规律。
制备载药微球过程中,微球的载药量和包封率受许多因素的影响,主要的因素有:PLGA 的组成、主药的理化性质、各溶剂相的用量、微球制备方法及制备参数等。
-
PLGA 的组成:PLGA 的相对分子质量和乳酸/羟基乙酸(LA/GA)比例可控,选用不同的PLGA 制备微球可得到不同的载药量和包封率。
-
PLGA 在第一相中的浓度
微球的载药量随着 PLGA 浓度增加而提高。可以从 3 个方面解释这个现象:
① 高浓度的聚合物可以加速微球的固化,并可有效阻止药物向外相的扩散;
② 高浓度的聚合物可以增加有机相的黏度,从而减缓小液滴中药物的扩散;
③ 高浓度的聚合物制备出相对较大粒径的微球,在清洗微球表面药物时较小粒径微球损失的药物要少。
-
PLGA 在有机溶剂中的溶解性
PLGA 在有机溶剂中的溶解度决定了微球的固化速率,较高的溶解度会延长微球固化时间,导致更多的药物扩散到连续相中,降低包封率。一般来说,相对高的 LA/GA 比例组成、低分子质量、末端闭合的 PLGA 亲水性较差,在二氯甲烷中的溶解性较好,选用此类型的 PLGA 制备的微球包封率较低。此外,PLGA 的亲水性还可增加初乳的稳定性,从而获得高包封率。
-
药物理化性质的影响
药物的理化性质决定溶剂系统的组成及制备方法的选择。通常疏水物质宜选用 O/W 法,亲水性物质选用 O/O 和 W/O/O 法可以获得高包封率;水溶性化合物,如在有机溶剂中不稳定的物质(如蛋白质和多肽类),宜选用 W/O/W 技术。若药物为多肽或氨基酸、酶等,还应考虑其在微球制备过程中的稳定性。为了增加蛋白质的稳定性,可以考虑在微球制备过程中加入两亲性稳定剂、碱性盐或者冻干保护剂等。
-
药物与聚合物的比例
提高聚合物和药物的比例可有效阻止微球制备过程中药物向外相的渗漏,从而获得高的包封率。
-
药物与聚合物之间的作用
药物与聚合物之间的作用也会影响微球的包封率。通常,亲水性药物与末端含有亲水基团的 PLGA 结合所得微球包封率较高,而疏水性药物与相对疏水的末端闭合的 PLGA 结合所得微球的包封率较高。
-
药物在第二相中的溶解性
微球的固化过程是造成药物损失的一个重要环节。如果药物在第二相中的溶解度大于在第一相中的溶解度,将更容易扩散到第二相中,导致微球包封率降低。用 W/O/W 法制备亲水性蛋白质类药物微球时,可通过两种方法提高亲水性药物微球包封率:
① 调节第二相的 pH值、渗透压(加盐)等,使蛋白质溶解性降低。pH 值影响蛋白质的溶解度,随着 pH值的降低,蛋白质的溶解度也降低;
② 制备蛋白质的包合物或 Zn 复合物,降低其在第二相中的溶解度。
-
溶剂的影响
溶剂的理化性质,如沸点、挥发性及与其他溶剂的互溶性等因素,关系到药物或者聚合物在溶剂中的溶解度以及溶剂去除的速率。
➺ 溶剂种类和组成
有机溶剂对微球的包封率和释放有显著影响。采用复乳法制备蛋白微球时,通常选择二氯甲烷、乙腈、乙酸乙酯、丙酮、二甲亚砜等有机溶剂作为溶解聚合物的介质。为了改变药物或者聚合物在溶剂中的溶解度,可以在溶剂中加入其他溶剂改变其理化性质。在有机相中加入能与水混溶的有机溶剂如丙酮、甲醇、乙酸乙酯、二甲基亚砜等,可以提高水溶性药物的溶解度,提高微球的载药量和包封率。在内相中加入极性溶剂可以加快萃取过程,促进微球的快速形成,抑制药物向外水相的扩散,从而提高微球的包封率。
➺ 溶剂体积
使用乳化溶剂挥发法制备微球时,第一相和第二相的比例是微球载药量的重要影响因素。降低第一相/第二相比例能显著增加微球载药量和包封率,减少突释。因为增大第二相的量可达到稀释溶剂的效果,从而使有机溶剂以高浓度梯度跨过相界面。
➺ 溶剂去除速率
当药物易分配到连续相中时,溶剂去除速率就成为一个关键影响因素。在乳化-溶剂挥发或者乳化溶剂萃取法中,有机溶剂可以在其沸点附近挥发或者被从第二相萃取出来。前者的速率可以由蒸发温度控制,后者的速率可以由稀释介质的量来控制。有研究考察了不同温度下制得微球包封率情况,发现升高温度在加快有机溶剂去除速率的同时,也会增加某些药物在外水相的溶解度,加快向外水相的质量传递,而且不适用于高温不稳定的药物。
➺ 添加剂
PLGA 因其固有的疏水性对亲水性强的分子的亲和力低,所以包封这些分子时的效率不高,造成制备过程中活性物质的大量损失。为提高 PLGA 微球包封率,引入添加剂可以有效解决这一问题。
常用的附加剂有多元醇类(如甘露醇、海藻糖、山梨醇等),非离子表面活性剂(如聚山梨酯20、司盘80、普朗尼克F68等),大分子化合物[人血清蛋白(HSA)、聚乙二醇(PEG)、羟丙基-β-环糊精(HP- β-CD)]等。在复乳溶剂挥发/萃取法中,可以在内外水相或者油相中加入一些物质,如鼠血清白蛋白、吐温 80、司盘 80、PVA 等来提高初乳稳定性,防止内外水相合并,从而提高包封率。此外,还可以通过调节外水相乳化剂或电解质的浓度的方法,改变药物和有机溶剂在水相中的溶解度。
一般来说,在外水相加入一定浓度的电解质(如氯化钠),可以获得高包封率,可能与内外水相间渗透压梯度形成有关。
与其他传统剂型相比,注射用缓释微球制剂在药物制剂和临床诊断/治疗领域商品化速度相对缓慢,并且微球制剂从实验室阶段的初期研发走向临床应用需要经历漫长的过程,主要有以下几个瓶颈需要解决:
-
各国药品监督评审机构并没有针对缓释微球制剂推出专门的监管和评审要求;
-
微球制剂的放大生产受到设备自动化的制约,难以大规模、大批量制备,导致成本过高,并且重复性较差;
-
FDA 批准用于临床的生物可降解高分子聚合物的种类及规格有限;
-
载药微球进入人体后,降解释放以及与组织间发生作用的机制机理尚不清晰明确,毒性和安全性评价还需进一步验证。
近年来,新型给药系统研究与开发的投入和支持逐年增加,对于蛋白及多肽类药物的新型缓释/控释注射给药系统的研究也成为热门。而从实验室技术取得成功到逐级放大生产发展到产业化规模,其间须逾越层层障碍。如何在保持基础研究成果的条件下,降低成本,逐步扩大产量,直至产业化生产,也是接下来发展新型给药系统中紧迫而又重要的任务。
另外,缓释微球技术长期以来被发达国家的药企垄断,直到近十几年,国内各大药企才投入大量的人力与资金开展对微球制剂的研究。目前已有亮丙瑞林微球成功上市,曲普瑞林微球和利培酮微球正在临床试验中,相信在不久的将来,会有越来越多的微球制剂产品成功走向市场。
-END-
关于我们:
北京新领先成立于 2005 年,注册资金近亿元,于 2015 年实现上交所上市(股票代码:600222),是一家面向全球提供药学临床前研究、临床 CRO 和CDMO服务的高新技术企业,连续多年蝉联“中国医药研发公司榜首”。
目前,公司已与国内外上下游500余家企业建立合作关系,其中部分企业为战略合作关系。累计承接了药学研发项目400余项、临床研究项目500余项,申请专利200余项,获得授权近百项。
公司从建立伊始就以“是我,让中国新药技术和生产工艺与世界同步”作为企业愿景,致力于用创新的研发和服务模式以及信息化技术推动中国医药产业发展,缩小与世界先进水平间的差距,让中国人民早日用上安全药和良心药!
公司总部位于北京中关村高新技术园区,拥有 10000 平米研发实验室,同时在郑州临空生物园区建立了新药筛选及检测平台、药物评价平台(动物房,GLP、AAALAC、CNAS 认证)、大分子中试及大规模生产服务平台、小分子 CMC 制剂研究生产平台、细胞技术服务平台和临床 CRO 平台等六大符合国际标准(FDA、EMA 和 NMPA GMP 标准)的研发平台,形成“新领先 CXO”全产业链服务体系。仿创结合,双引擎驱动,能够为客户提供药学研发全生命周期的多元化服务。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
